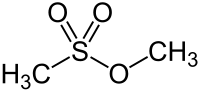
Methylmethansulfonat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Methylmethansulfonat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H6O3S | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 110,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,30 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
203 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser (200 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,4140 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Methylmethansulfonat ist eine chemische Verbindung aus der Gruppe der Sulfonate.
Gewinnung und Darstellung
Methylmethansulfonat kann durch Veresterung von Methansulfonsäure mit Methanol gewonnen werden.[3]
Eigenschaften
Methylmethansulfonat ist eine brennbare, schwer entzündbare, farblose bis gelbliche Flüssigkeit mit stechendem Geruch, die leicht löslich in Wasser ist.[1]
Verwendung
Methylmethansulfonat wird in Tierversuchen als Karzinogen verwendet.[4]
Weblinks
Einzelnachweise
- ↑ a b c d e f g h i j k Eintrag zu Methylmethansulfonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Datenblatt Methyl methanesulfonate, 99% bei Alfa Aesar, abgerufen am 20. Juli 2021 (Seite nicht mehr abrufbar).
- ↑ Andrew Teasdale, Stephen C. Eyley, Ed Delaney, Karine Jacq, Karen Taylor-Worth, Andrew M. Lipczynski, Van D. Reif, David E. Elder, Kevin L. Facchine, Simon Golec, Rolf Schulte Oestrich, Pat Sandra, Frank David: Mechanism and Processing Parameters Affecting the Formation of Methyl Methanesulfonate from Methanol and Methanesulfonic Acid: An Illustrative Example for Sulfonate Ester Impurity Formation. In: Organic Process Research & Development. 2009, Band 13, Nummer 3, S. 429–433 doi:10.1021/op800192a. PDF.
- ↑ Jan Murken: Humangenetik. Georg Thieme Verlag, 2006, ISBN 978-3-13-139297-8, S. 59 (books.google.com).


