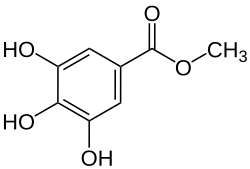
Methylgallat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Methylgallat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H8O5 | ||||||||||||||||||
| Kurzbeschreibung |
weißer bis gelblicher Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 184,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Methylgallat ist eine chemische Verbindung aus der Gruppe der Phenole und der Methylester der Gallussäure.
Vorkommen
Methylgallat kommt natürlich in den Blättern des Blasenbaumes (Koelreuteria paniculata)[2], sowie in Euphorbien, Geranium, dem Chinesischen Talgbaum (Sapium sebiferum), Acacia, Spirogyra-Algen, Rhus glabra und Pelargonium sidoides vor.[3]
Gewinnung und Darstellung
Methylgallat kann durch Veresterung von 3,4,5-Trihydroxybenzoesäure (Gallussäure) mit Methanol in Gegenwart von Schwefelsäure synthetisiert werden.[4]
Eigenschaften
Methylgallat ist ein weißes bis gelbliches, kristalles Pulver, das schwer löslich in Wasser ist.[1] Die Verbindung wirkt antibiotisch und ist in vitro ein hochwirksamer spezifischer Hemmstoff von Herpes simplex.[2][5][6]
Methylgallat besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2). Diese besteht im Wesentlichen aus einer planaren Anordnung der Moleküle. Die Wasserstoffatome der drei Hydroxylgruppen, die gleichzeitig als Wasserstoffbindungsdonatoren und -akzeptoren fungieren, sind in der gleichen Richtung um den aromatischen Ring herum angeordnet. Zusätzlich zu den zwei intramolekularen Wasserstoffbrückenbindungen ist jedes Molekül mit sechs weiteren Wasserstoffbrückenbindungen verbunden, wodurch ein dreidimensionales Wasserstoffbrückenbindungsnetz entsteht.[7]
Verwendung
Methylgallat wird als Antioxidans und als Zwischenprodukt zur Herstellung von anderen Chemikalien verwendet.[8][9][10][11]
Weblinks
Einzelnachweise
- ↑ a b c d e f g h i j k l m Eintrag zu Methylgallat, >98.0% bei TCI Europe, abgerufen am 16. Juli 2025.
- ↑ a b Alfred Hagen Meyer: RÖMPP Lexikon Lebensmittelchemie, 2. Auflage, 2006. Thieme, 2014, ISBN 978-3-13-179282-2, S. 418 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ John W. Blunt, Murray H. G. Munro: Dictionary of Marine Natural Products. CRC Press, ISBN 978-1-04-022179-2, S. 51 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Tayseer Zidan, Salwa El-Sabbagh, Abbass Abdelkareem: Synthesis And Evaluation Of Methyl 3,4,5-Trihydroxybenzoate And Methyl 3,4,5-Trihydroxybenzohydrazide As Additives For Natural Rubber Composites. In: Egyptian Journal of Chemistry. Band 65, Nr. 2, 2022, S. 531–538, doi:10.21608/ejchem.2021.89385.4289.
- ↑ Jiaju Zhou, Guirong Xie, Xinjian Yan: Encyclopedia of Traditional Chinese Medicines. Springer Berlin Heidelberg, ISBN 978-3-642-16747-8, S. 584 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Cynthia J. M. Kane, Jay H. Menna, Yun-Chi Yeh: Methyl gallate, methyl-3,4,5-trihydroxy-benzoate, is a potent and highly specific inhibitor of herpes simplex virus in vitro. I. Purification and characterization of methyl gallate from Sapium sebiferum. In: Bioscience Reports. Band 8, Nr. 1, 1988, S. 85–94, doi:10.1007/BF01128975.
- ↑ D. Bebout, S. Pagola: Methyl gallate. In: Acta Crystallographica Section E: Structure Reports Online. Band 65, Nr. 2, 2009, S. o317–o318, doi:10.1107/S1600536809001123.
- ↑ Robert A. Lewis: Hawley's Condensed Chemical Dictionary. Wiley, 2016, ISBN 978-1-119-19372-2 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Handbook of Fluorous Chemistry. Wiley, ISBN 978-3-527-60449-4, S. 441 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Michael Ash: Handbook of Preservatives. Synapse Information Resources, 2004, ISBN 978-1-890595-66-1, S. 454 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Robert Kaplánek, Martin Havlík, Vladimír Král, Pavel Martásek, Tomáš Bříza: Methyl Gallate as the Framework for the Construction of Fluorous Building Blocks. In: Synthetic Communications. Band 40, Nr. 2, 2009, S. 247–256, doi:10.1080/00397910902964858.
