Lithiumorotat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
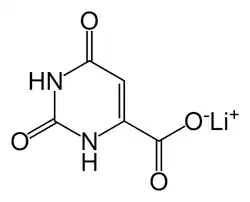
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lithiumorotat | ||||||||||||||||||
| Andere Namen |
Lithium-2,6-dioxo-1,2,3,6-tetrahydro-4-pyrimidincarboxylat (IUPAC) | ||||||||||||||||||
| Summenformel | C5H3LiN2O4 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 162,03 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Lithiumorotat ist das Salz der Orotsäure mit Lithium. Es wird verwendet, um dem Körper Lithiumionen zuzuführen. In der Lithiumtherapie psychiatrischer Erkrankungen kommt es, anders als andere Lithiumsalze, bislang nicht zum Einsatz.
Darstellung
Neutralisation von Orotsäure mit Lithiumhydroxid in wässrigem Medium ergibt das kristalline Monohydrat (Lithiumorotat × 1 H2O).[3] Während Lithiumcarbonat einen Massenanteil von 18 % Lithium enthält, sind es bei Lithiumorotat nur 3,83 %, wodurch eine bessere Lithiumionen-Dosierung möglich ist.
Verwendung
Wie andere Lithiumsalze (etwa Lithiumcarbonat) vermag Lithiumorotat die Blut-Hirn-Schranke zu durchdringen und somit anorganische Lithiumionen in das Gehirn zu transportieren.[4] Lithiumsalze werden therapeutisch in der Behandlung bestimmter psychiatrischer Erkrankungen wie etwa der bipolaren Störung eingesetzt.[5][6] Orotat ist das Anion einer organischen Säure und ein Intermediat im Stoffwechsel des Uridinmonophosphats. In den Jahren von 1973 bis 1986 wurde auch die Möglichkeit der medizinischen Anwendung von Lithiumorotat z. B. bei Alkoholismus[7] und der Alzheimer-Krankheit erforscht.[4] Ansonsten ist der therapeutische Einsatz von Lithiumorotat kaum untersucht und Lithium ist den USA oder den EU-Staaten nicht als Orotatsalz (Stand 2025) in Fertigarzneimitteln vertreten.
Lithiumorotat wird in einigen Ländern als Nahrungsergänzungsmittel vermarktet.[8] Wenngleich Lithium nicht als ein essentielles Spurenelement gilt, wird einer „Low-dose Lithium Supplementation“ („Microdosing“, Niedrig-Dosis-Zufuhr) von einigen Forschern eine günstige gesundheitsbezogene Wirkung zugeschrieben.[9][10][11] In den EU-Staaten ist das Inverkehrbringen als Nahrungsergänzungsmittel nicht statthaft.[12] Arzneilich eingesetztes Lithiumorotat ist in Deutschland unabhängig von der Dosis verschreibungspflichtig.[13]
In einer im August 2025 erschienenen Studie war in Blut- und Gehirnproben Lithium das einzige Metall, dessen Mangel signifikant zwischen Menschen mit und ohne leichte kognitive Beeinträchtigung unterschied; bei Mäusen führte Lithiummangel zu Alzheimer-Symptomen; Lithiumorotat war eines mehrerer Lithiumsalze, die nicht an Amyloid-Beta-Proteine (Plaques) binden und deshalb dem Gehirn zur Verfügung stehen. Die Studie beobachtete an Mäusen, dass die Gabe von Lithiumorotat bereits in sehr geringen Dosen wirksam und ausreichend war, um den Lithiumspiegel im Gehirn wiederherzustellen und die Alzheimer-Symptome zu bessern, Nebenwirkungen wurden nicht festgestellt.[14][15]
Pharmakologie
Hans Nieper postulierte 1973, dass Lithiumorotat erst nach der Überquerung der Blut-Hirn-Schranke zu den freien Ionen dissoziieren würde.[16] D. F. Smith zeigte allerdings 1976, dass sich die Lithium-Konzentration in Rattenhirn bei Gabe äquivalenter Mengen von Lithiumorotat, -carbonat oder Lithiumchlorid nicht signifikant unterschied.[17] In einer Studie von 1978 wurde wiederum gezeigt, dass in den ersten 8 Stunden nach einer Intraperitonealen Injektion in Ratten die Lithium-Konzentration im Hirn bei Verwendung des Orotatsalzes schon signifikant höher war als beim Carbonat. Während 24 Stunden nach Injektion von 2 Massenäquivalenten Lithiumcarbonat pro kg Körpergewicht nur wenig Serum-Lithium vorhanden war, waren es bei Lithiumorotat noch zwei drittel des Wertes von 2 Stunden nach Injektion. Außerdem war die Lithium-Konzentration im Gehirn 24 Stunden nach Gabe des Orotats dreimal größer als nach Gabe des Carbonats. So gesehen kann davon ausgegangen werden, dass bereits mit niedrigeren Dosen von Lithiumorotat statt Lithiumcarbonat eine therapeutische wirksame Lithium-Konzentration im Hirn erzeugt werden kann, einhergehend mit stabileren Konzentrationen im Serum.[18]
Ein Jahr später wiederholten Smith und Schou das Experiment mit höherer Dosis (2 mM Li+) und fanden, dass die höheren Lithium-Konzentrationen im Hirn möglicherweise durch verminderte Nierenfunktion bei den mit Lithiumorotat behandelten Ratten erklärt werden könnte.[19][4] Befürworter einer „Low-Dose-Therapy“ mit Lithiumorotat kritisieren seither die Ergebnisse aufgrund der Tatsache, dass die angewandte Dosis des Stoffes im toxischen Bereich lag. 2022 wiederholte daher Pacholko das Experiment um zu zeigen, dass das Orotat in Bezug auf die Nierenfunktion sicherer ist als das Carbonat und zeigte auch, das beide Salze für erhöhte Bildung von Thyreotropin in weiblichen Ratten hervorriefen, wobei dieser Effekt beim Orotat schwächer war.[20]
Die Pharmakokinetik von Lithiumorotat im menschlichen Gehirn ist bisher kaum untersucht und es gibt keinen bekannten Mechanismus, nach dem die Orotationen die Pharmakokinetik des dissoziierten Lithiumions beeinflussen könnten. Jedoch scheint die Lithiumaufnahme auch bei niedrigen Dosen effizient zu sein, was für die behauptete Eignung einer Mikrodosis-Lithiumbehandlung zur Vorbeugung von kognitivem Verlust[21][22] und vermeintlichen metabolischen Gehirnveränderungen bei psychotischen Patienten[23] hindeutet. Der Grund für das Vorliegen nur weniger Untersuchungen über Lithiumorotat im Vergleich zum Carbonat sind Bedenken aus dem Jahr 1979 von verstärkter Nierentoxizität dieses speziellen Salzes.[4] Es ist wahrscheinlich, dass diese Bedenken von der Verwendung exzessiv hoher Konzentrationen von Lithiumorotat in den frühen Studien herrührten. Im Ergebnis wurden die klinischen Anwendungen oder weitere Untersuchungen seit den 1980ern für Jahrzehnte pausiert. Das Interesse an Lithiumorotat besteht jedoch fort und die medizinische Forschung dazu wurde in den 2010ern erneut aufgenommen, hauptsächlich aufgrund der zugeschriebenen Eigenschaft, höhere Lithium-Spiegel im Serum und Gehirn zu bewirken als äquimolare Mengen anderer Salze.[4]
Sicherheit
Frühere Untersuchungen wiesen darauf hin, dass Lithiumorotat in niedrigen Dosen unschädlich ist. Die Gabe des Stoffes bei einem sechsmonatigen Alkoholentzug (150 mg täglich) führte bei 8 von 42 Patienten zu nur geringen Nebenwirkungen.[7] Vor dem Hintergrund der breiten Verwendung in der Selbstmedikation und der einfachen Bezugsmöglichkeit fordern Wissenschaftler dennoch mehr klinische und Grundlagenforschung.[4] Aufmerksamkeit erzielte der Stoff 2007 in den USA nach einem Vergiftungsfall einer 18 Jahre alten Frau mit milden Anzeichen einer akuten Lithium-Vergiftung nach der Einnahme einer hohen Dosis (2,16 g) eines über das Internet bezogenen Lithiumorotat-Präparats. Sie wurde nach erfolgreicher Behandlung entlassen.[24][25]
In somatischen Zellen von Säugetieren kann Orotsäure bei sehr hohen Dosen (50 mg/kg) mutagen wirken.[26] Sie ist auch für Bakterien und Hefen mutagen.[27] Lithiumorotat ist nicht genotoxisch.[28] Kurz- und Langzeittoxizitätstudien sind erforderlich, um bestehende Sicherheitsbedenken auszuräumen.[4]
Einzelnachweise
- ↑ a b c d W.L.F. Armarego, Christina Li Lin Chai: Purification of Laboratory Chemicals. Butterworth-Heinemann, 2013, ISBN 0-12-382161-4, S. 987 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Ina Bach, Otto Kumberger, Hubert Schmidbaur: Orotate complexes. Synthesis and crystal structure of lithium orotate(—I) monohydrate and magnesium bis[ orotate(—I)] octahydrate. In: Chemische Berichte. Band 123, Nr. 12, Dezember 1990, S. 2267–2271, doi:10.1002/cber.19901231207.
- ↑ a b c d e f g Anthony G. Pacholko, Lane K. Bekar: Lithium orotate: A superior option for lithium therapy? In: Brain and Behavior. Band 11, Nr. 8, August 2021, doi:10.1002/brb3.2262 (englisch).
- ↑ G. Geisslinger, S. Menzel, T. Gundermann, B. Hinz, P. Roth (Hrsg.): Mutschler Arzneimittelwirkungen. 11. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2020, S. 220 f.
- ↑ Isabelle Viktoria Maucher: Lithium - Anwendung, Wirkung, Nebenwirkungen. In: gelbe-liste.de. 19. Juli 2019, abgerufen am 26. Mai 2025.
- ↑ a b H.E. Sartori: Lithium orotate in the treatment of alcoholism and related conditions. In: Alcohol. Band 3, Nr. 2, März 1986, S. 97–100, doi:10.1016/0741-8329(86)90018-2 (englisch).
- ↑ R. Balon: Possible dangers of a "nutritional supplement" lithium orotate. In: Annals of clinical psychiatry : official journal of the American Academy of Clinical Psychiatrists. Band 25, Nummer 1, Februar 2013, S. 71, PMID 23376874.
- ↑ Sophie I. Hamstra, Brian D. Roy, Peter M. Tiidus, Adam J. MacNeil, Panagiota Klentrou, Rebecca E. K. MacPherson, Val A. Fajardo: Beyond its Psychiatric Use: The Benefits of Low-dose Lithium Supplementation. In: Current Neuropharmacology. 2022, Band 21, Nummer 4, S. 891–910 doi:10.2174/1570159X20666220302151224.
- ↑ Daria Szklarska, Piotr Rzymski: Is Lithium a Micronutrient? From Biological Activity and Epidemiological Observation to Food Fortification. In: Biological Trace Element Research. 2018, Band 189, Nummer 1, S. 18–27 doi:10.1007/s12011-018-1455-2.
- ↑ Markus Donix, Michael Bauer: Population Studies of Association Between Lithium and Risk of Neurodegenerative Disorders. In: Current Alzheimer Research. 2016, Band 13, Nummer 8, S. 873–878 doi:10.2174/1567205013666160219112957.
- ↑ Lithiumorotat. In: verbraucherzentrale.de. 16. Oktober 2024, abgerufen am 26. Mai 2025.
- ↑ Arzneimittelverschreibungsverordnung (AMVV) § 1, Nr. 1.
- ↑ Liviu Aron, Zhen Kai Ngian, Chenxi Qiu, Jaejoon Choi, Marianna Liang, Derek M. Drake, Sara E. Hamplova, Ella K. Lacey, Perle Roche, Monlan Yuan, Saba S. Hazaveh, Eunjung A. Lee, David A. Bennett, Bruce A. Yankner: Lithium deficiency and the onset of Alzheimer’s disease. In: Nature. 6. August 2025, ISSN 0028-0836, doi:10.1038/s41586-025-09335-x (englisch).
- ↑ Zusammenfassung auf Deutsch zum Artikel von Aron, L., Ngian et al., Nature 2025
- ↑ H. A. Nieper: The clinical applications of lithium orotate. A two years study. In: Agressologie. Band 14, Nr. 6, 1973, S. 407–411, PMID 4607169 (englisch).
- ↑ D.F. Smith: Lithium orotate, carbonate and chloride: pharmacokinetics, polydipsia and polyuria in rats. In: British Journal of Pharmacology. Band 56, Nr. 4, April 1976, S. 399–402, doi:10.1111/j.1476-5381.1976.tb07449.x (englisch).
- ↑ Mitchel A Kling, Paul Manowitz, Irwin W Pollack: Rat brain and serum lithium concentrations after acute injections of lithium carbonate and orotate. In: Journal of Pharmacy and Pharmacology. Band 30, Nr. 1, 1. September 1978, S. 368–370, doi:10.1111/j.2042-7158.1978.tb13258.x (englisch).
- ↑ Donald F Smith, Mogens Schou: Kidney function and lithium concentrations of rats given an injection of lithium orotate or lithium carbonate. In: Journal of Pharmacy and Pharmacology. Band 31, Nr. 1, 1. September 1979, S. 161–163, doi:10.1111/j.2042-7158.1979.tb13461.x (englisch).
- ↑ Anthony G. Pacholko, Lane K. Bekar: Different pharmacokinetics of lithium orotate inform why it is more potent, effective, and less toxic than lithium carbonate in a mouse model of mania. In: BioRxiv. 1. Mai 2022, abgerufen am 25. Mai 2025 (englisch).
- ↑ B. Alevizos, E. Alevizos, A. Leonardou, I. Zervas: Low dosage lithium augmentation in venlafaxine resistant depression: an open-label study. In: Psychiatriki. Band 23, Nr. 2, 2012, S. 143–148, PMID 22796912 (englisch).
- ↑ Marielza Andrade Nunes, Tania Araujo Viel, Hudson Sousa Buck: Microdose Lithium Treatment Stabilized Cognitive Impairment in Patients with Alzheimer's Disease. In: Current Alzheimer Research. Band 10, Nr. 1, 1. Januar 2013, S. 104–107, doi:10.2174/156720513804871354 (englisch).
- ↑ Gregor E. Berger, Stephen J. Wood, Margaret Ross, Clare A. Hamer, R. Mark Wellard, Gaby Pell, Lisa Phillips, Barnaby Nelson, G. Paul Amminger, Alison R. Yung, Graeme Jackson, Dennis Velakoulis, Christos Pantelis, Husseini Manji, Patrick D. McGorry: Neuroprotective Effects of Low-dose Lithium in Individuals at Ultra-high Risk for Psychosis. A Longitudinal MRI/MRS Study. In: Current Pharmaceutical Design. Band 18, Nr. 4, S. 570–575, doi:10.2174/138161212799316163 (englisch).
- ↑ D. K. Pauzé, D. E. Brooks: Lithium toxicity from an internet dietary supplement. In: Journal of Medical Toxicology. Band 3, Nr. 2, Juni 2007, S. 61–62, doi:10.1007/BF03160910 (englisch).
- ↑ Della Kwan, Joseph Beyene, Prakesh S Shah: Adverse Consequences of Internet Purchase of Pharmacologic Agents or Dietary Supplements. In: Journal of Pharmacy Technology. Band 25, Nr. 6, November 2009, S. 355–360, doi:10.1177/875512250902500602 (englisch).
- ↑ Vitamin B13 cannot be proven safe, says EFSA. In: nutraingredients.com. 29. Juli 2009, abgerufen am 25. Mai 2025 (englisch).
- ↑ Material Safety Data Sheet - Orotic Acid, anhydrous MSDS. In: ScienceLab.com. 21. Mai 2013, archiviert vom am 20. Januar 2018.
- ↑ Timothy S. Murbach, Róbert Glávits, John R. Endres, Gábor Hirka, Adél Vértesi, Erzsébet Béres, Ilona Pasics Szakonyiné: A toxicological evaluation of lithium orotate. In: Regulatory Toxicology and Pharmacology. Band 124, August 2021, S. 104973, doi:10.1016/j.yrtph.2021.104973 (englisch).