Lithiumdiethylamid
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
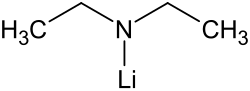
| ||||||||||
| Allgemeines | ||||||||||
| Name | Lithiumdiethylamid | |||||||||
| Summenformel | C4H10LiN | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 79,1 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Löslichkeit |
löslich in Tetrahydrofuran und Diethylether[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Lithiumdiethylamid ist eine organische Verbindung aus der Gruppe der Metallamide und ein Derivat des Diethylamins.
Herstellung
Lithiumdiethylamid kann durch Reaktion von Diethylamin mit Methyllithium gewonnen werden.[3] Alternativ ist auch die Umsetzung von Diethylamin mit Phenyllithium, Butyllithium oder unter bestimmten Bedingungen, beispielsweise unter Zusatz von HMPT, durch Reaktion von Diethylamin mit elementarem Lithium.[2]
Eigenschaften
Lithiumdiethylamid ist ein extrem pyrophorer, weißer Feststoff, der mit Wasser heftig reagiert.[2][4] In reinen Kohlenwasserstoff-Lösungsmitteln ist es unlöslich, es ist jedoch löslich in Tetrahydrofuran, Diethylether sowie Mischungen von Diethylether mit Hexan oder Benzol.[2]
Reaktionen
Lithiumdiethylamid wird als nukleophiles Reagenz und starke Base verwendet.[2] Durch Reaktion mit α,ω-Dinitrilen wie Suberonitril können makrocyclische Verbindungen hergestellt werden. Dies war eine der ersten bekannten Methoden, mit denen dies in guter Ausbeute möglich war.[5] Lithiumdiethylamid wurde in verschiedenen organischen Synthesen als Base eingesetzt, beispielsweise bei der Herstellung von Dec-7-eno-1,4-lacton[6] und Digitoxigenin.[7]
Einzelnachweise
- ↑ a b c Datenblatt Lithiumdiethylamid, ≥95% bei Sigma-Aldrich, abgerufen am 15. Juni 2025 (PDF).
- ↑ a b c d e Masao Tsukazaki, Victor Snieckus, Michael J. Coghlan: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, 2006, ISBN 978-0-470-84289-8, Lithium Diethylamide, doi:10.1002/047084289x.rl096.pub2.
- ↑ Henry Gilman, N. N. Crounse, S. P. Massie, R. A. Benkeser, S. M. Spatz: Rearrangement in the Reaction of α-Halogenonaphthalenes with Lithium Diethylamide. In: Journal of the American Chemical Society. Band 67, Nr. 12, Dezember 1945, S. 2106–2108, doi:10.1021/ja01228a015.
- ↑ Bretherick's Handbook of Reactive Chemical Hazards. Academic Press, ISBN 978-0-08-052340-8, S. 2164 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ K. Ziegler, H. Eberle, H. Ohlinger: Über vielgliedrige Ringsysteme. I. Die präparativ ergiebige Synthese der Polymethylenketone mit mehr als 6 Ringgliedern. In: Justus Liebigs Annalen der Chemie. Band 504, Nr. 1, Januar 1933, S. 94–130, doi:10.1002/jlac.19335040109.
- ↑ Dermot J. Gavin, Niall W. A. Geraghty: A General Synthesis of (±)-γ-Substituted γ-Butyrolactones Using a Kinetic Alkylation-Ozonolysis Procedure. In: Synthetic Communications. Band 24, Nr. 10, Mai 1994, S. 1351–1361, doi:10.1080/00397919408011738.
- ↑ Gilbert Stork, Fred West, Hee Yoon Lee, Richard C. A. Isaacs, Shino Manabe: The Total Synthesis of a Natural Cardenolide: (+)-Digitoxigenin. In: Journal of the American Chemical Society. Band 118, Nr. 43, 1. Januar 1996, S. 10660–10661, doi:10.1021/ja962163m.

