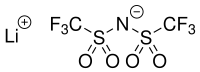
Lithiumbis(trifluormethylsulfonyl)amid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lithiumbis(trifluormethylsulfonyl)amid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | LiC2NO4F6S2 | ||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 287,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,15 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
234–238 °C[1] | ||||||||||||||||||
| Löslichkeit |
wenig in Wasser (10 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Lithiumbis(trifluormethylsulfonyl)amid ist das Lithiumsalz des Bis(trifluormethansulfonyl)amids mit der Summenformel LiC2NO4F6S2. Es wird unter anderem in Lithium-Ionen-Akkus als Elektrolyt verwendet.[3][4][5] Außerdem wird es in der Synthese von ionischen Flüssigkeiten als Quelle des Bistriflimid-Anions verwendet.
Einzelnachweise
- ↑ a b c d e Datenblatt Bis(trifluoromethane)sulfonimide lithium salt bei Sigma-Aldrich, abgerufen am 2. Oktober 2024 (PDF).
- ↑ a b Eintrag zu Lithium-bis(trifluormethylsulfonyl)imid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2025. (JavaScript erforderlich)
- ↑ Julian Kalhoff, Dominic Bresser, Marco Bolloli, Fannie Alloin, Jean-Yves Sanchez: Enabling LiTFSI-based Electrolytes for Safer Lithium-Ion Batteries by Using Linear Fluorinated Carbonates as (Co)Solvent. In: ChemSusChem. Band 7, Nr. 10, Oktober 2014, S. 2939–2946, doi:10.1002/cssc.201402502.
- ↑ L. Suo, O. Borodin, T. Gao, M. Olguin, J. Ho: "Water-in-salt" electrolyte enables high-voltage aqueous lithium-ion chemistries. In: Science. Band 350, Nr. 6263, 20. November 2015, S. 938–943, doi:10.1126/science.aab1595.
- ↑ L. Smith, B. Dunn: Opening the window for aqueous electrolytes. In: Science. Band 350, Nr. 6263, 20. November 2015, S. 918–918, doi:10.1126/science.aad5575.


