Isonitrile
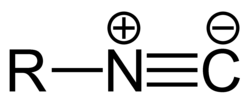
Isonitrile (ältere Benennung), bzw. Isocyanide (IUPAC-konformer Name), sind organisch-chemische Verbindungen der allgemeinen Struktur R-N≡C, wobei R ein kohlenstoffhaltiger Rest ist, wie ein Alkyl- oder Arylrest. Der Name leitet sich von den isomeren Nitrilen ab. Eine weitere veraltete Bezeichnung ist „Carbylamine“.
Geschichte
Vertreter der Stoffgruppe wurden erstmals 1866 von Armand Gautier synthetisiert und isoliert.[1]
Vorkommen
Natürliche Isonitrile sind eher selten. Die größte Gruppe stellen Verbindungen marinen Ursprungs dar, die meist zusammen mit analogen Formamiden und Isothiocyanaten vorkommen, die biosynthetisch aus den Isonitrilen gebildet werden. Neben den marinen Verbindungen sind auch noch andere Vertreter bekannt, beispielsweise das pilzliche Xanthocillin.[2] Ein von Bakterien gebildetes Isonitril ist das Aerocyanidin.[3]
Herstellung
Isonitrile entstehen in einer von August Wilhelm von Hofmann entdeckten Reaktion aus primären Aminen durch Umsetzung mit Chloroform und Alkali.[4][5] Sie bilden sich auch bei der Reaktion von Halogenalkanen mit Silbercyanid als Nebenprodukte der Kolbe-Nitrilsynthese.[6] Bevorzugt werden Isonitrile aus den Formamiden primärer Amine durch Wasserabspaltung mit Phosphoroxychlorid oder p-Toluolsulfonsäurechlorid hergestellt.[7] Die Bildung von Isonitrilen mit Chloroform und Kalilauge kann als Nachweis für primäre Amine verwendet werden; die Isonitrile sind leicht an ihrem äußerst unangenehmen Geruch erkennbar.[4]
Eigenschaften
Isonitrile sind übelriechende, reaktive und giftige Stoffe. Sie sind isoster mit Kohlenstoffmonoxid und daher gute Komplexliganden. Die Hydrolyse von Isonitrilen ergibt Ameisensäure und primäre Amine.
Verwendung
Isonitrile sind ein Schlüsseledukt in zahlreichen Multikomponenten-Reaktionen,[8] etwa in der Passerini-Reaktion, der Ugi-Reaktion und deren Varianten.
Einzelnachweise
- ↑ Lexikon bedeutender Chemiker, Harri Deutsch 1989.
- ↑ M. S. Edenborough, R. B. Herbert: Naturally occurring isocyanides. In: Natural Product Reports. Band 5, Nr. 3, 1988, ISSN 0265-0568, S. 229, doi:10.1039/np9880500229 (rsc.org [abgerufen am 2. September 2025]).
- ↑ William L. Parker, Marlene L. Rathnum, Janice H. Johnson, J. Scott Wells, Pacifico A. Principe, Richard B. Sykes: Aerocyanidin, a new antibiotic produced by Chromobacterium violaceum. In: The Journal of Antibiotics. Band 41, Nr. 4, 1988, ISSN 0021-8820, S. 454–460, doi:10.7164/antibiotics.41.454 (jst.go.jp [abgerufen am 2. September 2025]).
- ↑ a b Eintrag zu Isocyanide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Januar 2019.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 430–431, ISBN 3-342-00280-8.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1991, Seite 374–375, ISBN 3-7776-0485-2.
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, Seite 596.
- ↑ J. Zhu und H. Bienaymé: Multicomponent Reactions, Wiley-VCH, 2005, ISBN 978-3-527-30806-4.