Iridium(IV)-fluorid
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| _ Ir4+ _ F− | |||||||
| Allgemeines | |||||||
| Name | Iridium(IV)-fluorid | ||||||
| Andere Namen |
Iridiumtetrafluorid | ||||||
| Verhältnisformel | IrF4 | ||||||
| Kurzbeschreibung |
roter Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 268,21 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Iridium(IV)-fluorid ist eine chemische Verbindung des Iridiums aus der Gruppe der Fluoride.
Gewinnung und Darstellung
Iridium(IV)-fluorid kann durch Reaktion von Iridium(VI)-fluorid mit Schwefel, Metallen oder anderer Halogene gewonnen werden.[3]
Eigenschaften
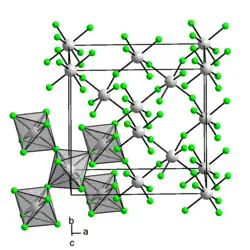
Iridium(IV)-fluorid ist ein roter Feststoff.[1] An feuchter Luft zersetzt es sich unter Aufblähen und Rotfärbung. In Wasser hydrolysiert es augenblicklich unter starker Wärmeentwicklung und Bildung von Iridium(IV)-oxid-Dihydrat und Fluorwasserstoff. Durch Reduktionsmittel wird es beim Erhitzen zu niederen Fluoriden reduziert.[3] Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Fdd2 (Raumgruppen-Nr. 43) und ist paramagnetisch.[4]
Einzelnachweise
- ↑ a b c Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 3181 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b H. J. Kandiner: Iridium. Springer-Verlag, 2013, ISBN 978-3-662-12128-3, S. 52 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ P.R. Rao, Alain Tressaud, Neil Bartlett: The tetrafluorides of iridium, rhodium and palladium. In: Journal of Inorganic and Nuclear Chemistry. 28, 1976, S. 23, doi:10.1016/0022-1902(76)80588-X.