Iodaceton
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
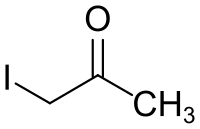
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Iodaceton | ||||||||||||||||||
| Summenformel | C3H5IO | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 183,98 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Iodaceton ist eine organische Verbindung aus der Gruppe der Ketone und ein iodiertes Derivat des Acetons.
Geschichte
Im Ersten Weltkrieg wurde Iodaceton als tränenreizender Kampfstoff getestet, hatte jedoch gegenüber anderen Verbindungen wie Ethyliodacetat, Bromaceton und Xylylbromid eine deutlich untergeordnete Bedeutung.[2]
Herstellung
Iodaceton kann durch Finkelstein-Reaktion von Chloraceton mit Kaliumiodid hergestellt werden.[3]
Reaktionen
Die Reaktion von Iodaceton mit O-Benzylhydroxylamin-Hydrochlorid wird Iodaceton-O-benzyloxim erhalten. Dieses eignet sich als Reagenz, um eine Acetonylgruppe in andere Verbindungen einzuführen.[3]
Iodaceton tritt als Intermediat in der Synthese von Dimethyl-2-oxopropylphosphonat auf. Dabei wird Chloraceton in situ durch Reaktion mit Kaliumiodid in Iodaceton umgewandelt und dann mit Trimethylphosphit umgesetzt. Das Produkt ist wiederum Vorläufer für die Synthese des Ohira-Bestmann-Reagenzes.[4]
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ L. Szinicz: History of chemical and biological warfare agents. In: Toxicology. Band 214, Nr. 3, Oktober 2005, S. 167–181, doi:10.1016/j.tox.2005.06.011.
- ↑ a b T. Severin, H. Lerche: Iodoaceton- O -benzyloxim, ein Reagenz zur Einführung der Acetonyl-Gruppe. In: Synthesis. Band 1982, Nr. 04, 1982, S. 305–307, doi:10.1055/s-1982-29790.
- ↑ Jörg Pietruszka, Andreas Witt: Synthesis of the Bestmann-Ohira Reagent. In: Synthesis. Band 2006, Nr. 24, 9. Oktober 2006, S. 4266–4268, doi:10.1055/s-2006-950307.