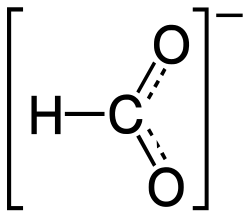
Hydraziniumformiat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Hydraziniumformiat | |||||||||
| Summenformel | CH6N2O2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 78,07 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Hydraziniumformiat ist eine organische Verbindung und das Salz des Hydrazins mit Ameisensäure.
Reaktionen
Mit Carbonylgruppen reagiert Hydraziniumformiat unter Bildung von Azinen, was sich auch als Schutzgruppe eignet. Die Entschützung funktioniert mit Triethylammoniumchlorochromat.[2]
Mit Raney-Nickel sowie Hydraziniumformiat als Wasserstoffdonor können Nitrogruppen und Nitrilgruppen zu Aminogruppen reduziert werden.[3] Mit Magnesium sowie Hydraziniumformiat als Wasserstoffdonor können Nitrogruppen selektiv reduziert werden. Diese Methode ist kompatibel mit anderen reduzierbaren Gruppen wie Nitrilen, Carbonsäuren, Estern und Halogenatomen.[4] Die Methode funktioniert analog auch mit Zink statt Magnesium.[5] Azidgruppen werden mit Hydraziniumformiat und Zink ebenfalls zu Aminen reduziert.[6]
Mit Cobalt-, Nickel- und Zinkionen reagiert Hydraziniumformiat unter Bildung von Komplexen, die das Hydrazinium-Ion als Ligand tragen, was ein seltener Fall eines positiv geladenen Liganden ist.[7]
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H. M. Nanjundaswamy, M. A. Pasha: Selective Protection of Carbonyl Compounds as Azines and Their Facile Regeneration. In: Synthetic Communications. Band 36, Nr. 21, 1. Oktober 2006, S. 3161–3165, doi:10.1080/00397910600908835.
- ↑ Shankare Gowda, D.Channe Gowda: Application of hydrazinium monoformate as new hydrogen donor with Raney nickel: a facile reduction of nitro and nitrile moieties. In: Tetrahedron. Band 58, Nr. 11, März 2002, S. 2211–2213, doi:10.1016/S0040-4020(02)00093-5.
- ↑ K. Abiraj, Shankare Gowda, D. Channe Gowda: MAGNESIUM/HYDRAZINIUM MONOFORMATE: A NEW HYDROGENATION SYSTEM FOR THE SELECTIVE REDUCTION OF NITRO COMPOUNDS. In: Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry. Band 32, Nr. 8, 26. September 2002, S. 1409–1417, doi:10.1081/SIM-120014858.
- ↑ Shankare Gowda, B. K. Kempe Gowda, D. Channe Gowda: Hydrazinium Monoformate: A New Hydrogen Donor. Selective Reduction of Nitrocompounds Catalyzed by Commercial Zinc Dust. In: Synthetic Communications. Band 33, Nr. 2, März 2003, S. 281–289, doi:10.1081/SCC-120015713.
- ↑ H. S. Prasad, G. R. Srinivasa, K. Abiraj, D. Channe Gowda: Hydrazinium Monoformate Mediated Facile Preparation of Amines from Azides Catalyzed by Zinc. In: ChemInform. Band 35, Nr. 48, 30. November 2004, doi:10.1002/chin.200448041.
- ↑ B. N. Sivasankar, S. Govindarajan: Formato Complexes of Co(II), Ni(II) and Zn(II) with the Hydrazinium(1+) Cation. In: Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry. Band 25, Nr. 1, Januar 1995, S. 031–043, doi:10.1080/15533179508218200.