Homoglutathion
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Homoglutathion | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C11H19N3O6S | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 321,35 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Homoglutathion ist ein dem Glutathion strukturverwandtes Thiol. Das Tripeptid (γ-L-Glutamyl-L-cysteinyl-β-alanin) ist aus den Aminosäuren Glutaminsäure, Cystein und β-Alanin aufgebaut. Es unterscheidet sich von Glutathion damit nur durch seine C-terminale Aminosäure.[2]
Homoglutathion ersetzt teilweise oder vollständig Glutathion in Leguminosen. Während in der Familie der Fabaceae die meisten Vertreter der Fabeae und Trifolieae beide homologe Tripeptide enthalten, bilden die Phaseoleae nur Homoglutathion.[3]
Homoglutathion übernimmt in den Phaseoleae viele Funktionen, die in anderen Pflanzen Glutathion zukommen. So dient Homoglutathion im Pflanzenkörper der Phaseoleae als Haupttransportform reduzierten Schwefels.[4] Homoglutathion ist die Vorstufe der Homophytochelatine, die in den Phaseoleae zur Bindung und Entgiftung von Schwermetallen dienen.[5] Auch ist Homoglutathion in Homologie zum Glutathion an der Entgiftung von Herbiziden über die Homoglutathion-Sulfotransferase-Reaktion beteiligt.[6] Zusätzlich spielt Homoglutathion eine Rolle als Reduktionsmittel bei der lichtabhängigen Wasserstoffperoxid-Entgiftung in den Chloroplasten der Phaseoleae.[7]
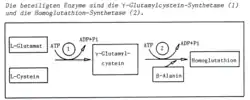
Homoglutathion wird in den Leguminosen aus den Aminosäuren L-Glutaminsäure, L-Cystein und β-Alanin in einem zweistufigen Prozess synthetisiert. Unter ATP-Verbrauch wird aus Glutaminsäure und Cystein γ-Glutamylcystein durch die Ligase γ-Glutamylcysteinsynthetase gebildet. Im zweiten Schritt der Synthesekette wird unter ATP-Verbrauch β–Alanin mithilfe des Enzyms Homoglutathionsynthetase an das terminale Kohlenstoffatom addiert.[8]
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ C. A. Price: A New Thiol in Legumes. In: Nature. Band 180, Nr. 4577, Juli 1957, S. 148–149, doi:10.1038/180148a0.
- ↑ S. Klapheck: Homoglutathione: isolation, quantification and occurrence in legumes. In: Physiologia Plantarum. Band 74, Nr. 4, Dezember 1988, S. 727–732, doi:10.1111/j.1399-3054.1988.tb02044.x.
- ↑ P.K. Macnicol, L. Bergmann: A role for homoglutathione in organic sulphur transport to the developing mung bean seed. In: Plant Science Letters. Band 36, Nr. 3, Oktober 1984, S. 219–223, doi:10.1016/0304-4211(84)90172-X.
- ↑ E. Grill, W. Gekeler, E.-L. Winnacker, H.H. Zenk: Homo‐phytochelatins are heavy metal‐binding peptides of homo‐glutathione containing Fabales. In: FEBS Letters. Band 205, Nr. 1, September 1986, S. 47–50, doi:10.1016/0014-5793(86)80863-8.
- ↑ E. Jay Breaux, James E. Patanella, Ernest F. Sanders: Chloroacetanilide herbicide selectivity: analysis of glutathione and homoglutathione in tolerant, susceptible, and safened seedlings. In: Journal of Agricultural and Food Chemistry. Band 35, Nr. 4, Juli 1987, S. 474–478, doi:10.1021/jf00076a009.
- ↑ Heinrich Zopes, Sigrid Klapheck, Ludwig Bergmann: The Function of Homoglutathione and Hydroxymethylglutathione for the Scavenging of Hydrogen Peroxide. In: Plant and Cell Physiology. Juni 1993, doi:10.1093/oxfordjournals.pcp.a078449.
- ↑ S. Klapheck, H. Zopes, H.‐G. Levels, L. Bergmann: Properties and localization of the homoglutathione synthetase from Phaseolus coccineus leaves. In: Physiologia Plantarum. Band 74, Nr. 4, Dezember 1988, S. 733–739, doi:10.1111/j.1399-3054.1988.tb02045.x.