Hexafluoroarsensäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
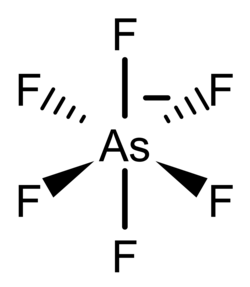
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hexafluoroarsensäure | ||||||||||||||||||
| Summenformel | H[AsF6] | ||||||||||||||||||
| Kurzbeschreibung |
geruchslose, farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 189,92 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Hexafluoroarsensäure ist eine anorganische Säure, bestehend aus dem Halbmetall Arsen und dem Halogen Fluor.
Eigenschaften
Die Hexafluoroarsensäure gilt als eine starke Brønsted-Säure.[3]
Sicherheitshinweise
Die Säure ist bei oraler Einnahme, Inhalation und Hautresorption giftig. Es reizt die Atemwege und verursacht schwere Verätzungen an der Haut und den Augen.[1] Analog zu anderen Arsenverbindungen ist die Hexafluoroarsensäure und ihre Salze krebserregend.[4]
Kontakt mit Glas, Säuren sowie starken Basen und Oxidationsmitteln sollte verhindert werden.[1]
Einzelnachweise
- ↑ a b c d e f Datenblatt Hexafluoroarsenic acid bei SynQuest, abgerufen am 25. März 2019 (PDF ( vom 25. Dezember 2021 im Internet Archive)).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Arsenverbindungen, mit Ausnahme der namentlich in diesem Anhang bezeichneten in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 3. März 2025. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ M. Feldman: Nanolithography: The Art of Fabricating Nanoelectronic and Nanophotonic Devices and Systems. Woodhead Publishing, 2014, ISBN 0-85709-875-6, S. 205.
- ↑ T. Nakajima, B. Žemva, A. Tressaud: Advanced Inorganic Fluorides: Synthesis, Characterization and Applications. Elsevier, 2005, ISBN 0-08-052548-2, S. 668.


