Frost-Diagramm
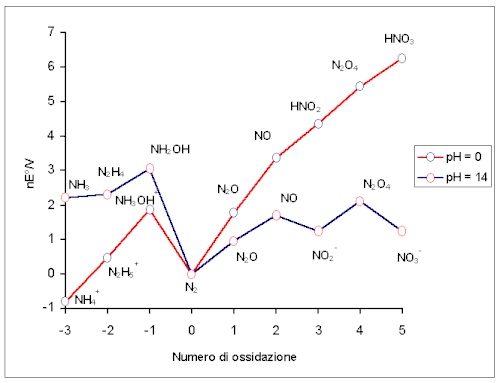
Ein Frost-Diagramm (auch Frost-Ebsworth-Diagramm oder Oxidationszustands-Diagramm, nicht zu verwechseln mit einem Frost-Musulin-Diagramm) ist eine grafische Darstellung von Reduktionspotentialen von Halbreaktionen – jeweils für die verschiedenen Oxidationsstufen eines Elements.[1] Mit einem Frost-Diagramm kann die thermodynamische Stabilität der Oxidationsstufen eines Elementes anschaulich dargestellt und diskutiert werden.[2] Zum Beispiel kann so erkannt werden, welche Oxidationsstufe thermodynamisch am stabilsten ist, oder welche zur Komproportionierung oder Disproportionierung neigen (s. u. Interpretation).[1][2]
Das Frost-Diagramm wurde von Arthur Frost im Jahre 1951 als Alternative zum Latimer-Diagramm vorgeschlagen[3] und 1964 durch Ebsworth bekannter gemacht.[4] Es wird ein kartesisches Koordinatensystem verwendet, wobei
- auf der Abszisse (x-Achse) die Oxidationszahl steht
- auf der Ordinate (y-Achse) üblicherweise -Werte der Halbreaktion einer Oxidationsstufe zur Oxidationsstufe (z. B. ).
Der Wert ist direkt proportional zur freien Enthalpie nach:
mit
- der Äquivalentzahl der übertragenen Elektronen
- der Faraday-Konstante F = 96 485 C/mol
- dem elektrochemischen Potential E.
Die Potentialdaten können sich auf elektrochemische Standardbedingungen beziehen () oder auf beliebige andere angegebene Bedingungen (beispielsweise ).
Erstellen

Am Beispiel eines Diagramms für Vanadium in saurer Lösung ():
- Die Standard-Potentiale der relevanten Redox-Gleichgewichte werden einem Tabellenwerk entnommen:
- Daraus werden die -Werte ermittelt:
- Die Werte werden in ein Koordinatensystem eingetragen.
Interpretation
Aus dem Diagramm lassen sich Informationen über spezielle Redox-Vorgänge gewinnen, sobald eine Oxidationsstufe auf einem Extremwert liegt:
- Befindet sich eine Verbindung im Frost-Diagramm auf einem Maximum, so ist der Zerfall in die beiden Stufen links und rechts davon (Disproportionierung) sehr wahrscheinlich. Eine Disproportionierung liegt z. B. vor, wenn Dithionat zu Sulfat und Sulfit reagiert (bzw. zu Schwefeltrioxid und Schwefeldioxid in wässriger Lösung).
- Liegt eine Verbindung jedoch auf einem Minimum, so ist die Reaktion von den beiden benachbarten Verbindungen zu ebendieser Oxidationsstufe (Komproportionierung) sehr wahrscheinlich. Beispielhaft für eine Komproportionierung ist die Reaktion von und zu (siehe Beispieldiagramm).
Quellen
- ↑ a b Michael Binnewies, Maik Finze, Manfred Jäckel, Peer Schmidt, Helge Willner Geoff Rayner-Canham: Allgemeine und Anorganische Chemie. 3., vollständig überarbeitete Auflage. Berlin 2016, ISBN 978-3-662-45067-3, S. 306–308.
- ↑ a b Peter W. Atkins, Tina Overton, Jonathan Rourke, Mark Weller, Fraser Armstrong, Mike Hagerman: Shriver & Atkins' inorganic chemistry. 5th ed Auflage. Oxford University Press, Oxford 2010, ISBN 978-0-19-923617-6, S. 164–168, 387, 391, 434, 437, 594.
- ↑ Arthur Atwater Frost: Oxidation Potential-Free Energy Diagrams. In: American Chemical Society ACS (Hrsg.): Journal of the American Chemical Society (JACS). Band 73, Nr. 6, 1951, S. 2680–2682, doi:10.1021/ja01150a074 (englisch).
- ↑ Evelyn Algernon Valentine Ebsworth: A Graphical Method Representing the Free Energies of Oxidation-Reduction Systems. In: RSC (Hrsg.): Education in Chemistry. Band 1, 1964, S. 123.
Weblinks
- 11.2. Hilfsmittel zur Darstellung von Redox-Gleichgewichten: Frost-Diagramme, LMU
- 6.5.1. Sauerstoffsäuren des Stickstoffs – Abbildung 6.5.1.: Frostdiagramm der N-O-Spezies (SVG-Datei), Albert-Ludwigs-Universität Freiburg
- Catherine E. Housecroft, Alan G. Sharpe: Inorganic Chemistry. 2. Auflage. Pearson Education, Harlow 2005, ISBN 978-0-13-039913-7, 7.6 Frost-Ebsworth diagrams, S. 205–207 (englisch, eingeschränkte Vorschau in der Google-Buchsuche – Hilfe zur Interpretation eines Frost-Diagramms).