Tebuconazol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| 1:1-Gemisch (Racemat) aus (R)-Form (oben) und (S)-Form (unten) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tebuconazol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C16H22ClN3O | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 307,82 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,25 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
zersetzt sich vor dem Sieden ab 165 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Tebuconazol ist ein Gemisch von zwei enantiomeren chemischen Verbindungen aus der Gruppe der Triazole.
Gewinnung und Darstellung
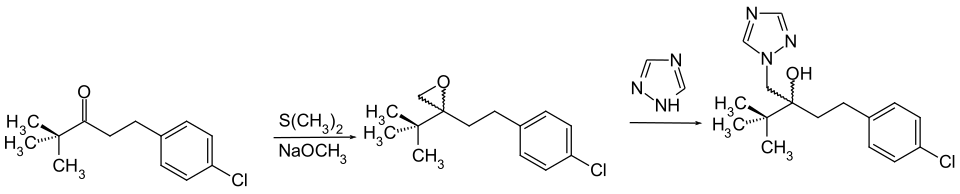
Tebuconazol kann durch Ringöffnung von 2-tert-Butyl-2-(4-chlorphenethyl)-oxiran mit 1,2,4-Triazol in Gegenwart einer Base gewonnen werden.[5][6]
Stereochemie
Da Tebuconazol ein Stereozentrum enthält, gibt es zwei Enantiomere dieses Wirkstoffs. Das technische Tebuconazol wird als 1:1-Gemisch (Racemat) der (R)- und der (S)-Form eingesetzt. Die R-Form ist das biologisch aktivere Isomer.[7]
Eigenschaften
Tebuconazol ist ein brennbarer, farb- und geruchloser Feststoff, der praktisch unlöslich in Wasser ist.[1] Es ist stabil gegenüber Hydrolyse bei pH-Werten zwischen 5 und 9 bei 20 °C.[7] Die oxidative Zersetzung unter Luft startet beim Erhitzen bei Temperaturen oberhalb von 200 °C. Hauptprodukte der Zersetzung sind 1-Chlor-4-ethenylbenzol, 4-Chlorbenzaldehyd und 1-(4-Chlorphenyl)ethanon.[8]
Verwendung
Tebuconazol wird als Fungizid verwendet.[1] Die Wirkung beruht auf einem Eingreifen des Stoffes in den Metabolismus der Pilzzellen. Dabei wird die Biosynthese von Ergosterin gehemmt, wodurch Funktionen der Zellmembranen gestört werden.[7] Die Verbindung wurde 1988 auf den Markt gebracht.[9]
Außerdem wirkt Tebuconazol als Wachstumsregulator in Pflanzen. Es hemmt die Gibberellinsäurebiosynthese und kann so zum Beispiel im Rapsanbau zu robusteren Pflanzen mit stabileren Wurzeln führen.[10]
Tebuconazol wird auch als fungizider Wirkstoff Biozidprodukten zugesetzt. Es findet dabei Verwendung in den Produktkategorien PT 7 (Beschichtungsmittel), PT 8 (Holzschutzmittel) und PT 10 (Schutzmittel für Mauerwerk).[11]
Zulassung
In der Europäischen Union dürfen seit September 2009 Pflanzenschutzmittel mit Tebuconazol für Anwendungen als Fungizid zugelassen werden.[12]
In vielen Staaten der EU, unter anderem in Deutschland und Österreich, sowie in der Schweiz sind Pflanzenschutzmittel (z. B. Folicur) mit diesem Wirkstoff zugelassen.[13]
Tebuconazol ist in der EU auch als Biozid zugelassen.[11]
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu Tebuconazol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ a b c European Food Safety Authority: Conclusion on the peer review of the pesticide risk assessment of the active substance tebuconazole. In: EFSA Journal. Band 12, Nr. 1, Januar 2014, doi:10.2903/j.efsa.2014.3485.
- ↑ Müller, F.; Ackermann, P.; Margot, P.: Fungicides, Agricultural, 2. Individual Fungicides in Ullmanns Enzyklopädie der Technischen Chemie, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.o12_o06.
- ↑ Eintrag zu Tebuconazole (ISO); 1-(4-Chlorphenyl)-4,4-dimethyl-3-(1,2,4-triazol-1-ylmethyl)pentan-3-ol in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 24. Januar 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu Tebuconazole in der Hazardous Substances Data Bank (via PubChem), abgerufen am 8. April 2013.
- ↑ Thomas A. Unger: Pesticide synthesis handbook. 1996, ISBN 978-0-8155-1401-5, S. 720 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Eintrag zu Tebuconazole in der Pesticide Properties DataBase (PPDB) der University of Hertfordshire, abgerufen am 18. März 2025.
- ↑ Monika Borucka, Maciej Celiński: Thermal Degradation and Combustion Behavior of Antifungal Pesticides: Triadimenol and Tebuconazole in Chem. Eng. Trans. 77 (2019) 139–144, doi:10.3303/CET1977024, Open Access.
- ↑ Horst Börner, Klaus Schlüter: Pflanzenkrankheiten und Pflanzenschutz. Springer, 2009, ISBN 3-540-49068-X, S. 496 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Peter Jeschke, Matthias Witschel, Wolfgang Krämer, Ulrich Schirmer: Modern crop protection compounds. volume 1: Herbicides. Third, completely revised and enlarged edition Auflage. Wiley-VCH, Weinheim 2019, ISBN 978-3-527-34089-7, S. 574 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Information on biocides - Tebuconazole. In: ECHA. European Chemicals Agency, abgerufen am 18. März 2025 (englisch).
- ↑ Richtlinie 2008/125/EG der Kommission vom 19. Dezember 2008 zur Änderung der Richtlinie 91/414/EWG des Rates zwecks Aufnahme von Aluminiumphosphid, Calciumphosphid, Magnesiumphosphid, Cymoxanil, Dodemorph, 2,5-Dichlorbenzoesäuremethylester, Metamitron, Sulcotrion, Tebuconazol und Triadimenol als Wirkstoffe (PDF).
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Tebuconazole in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs (Eingabe von „Tebuconazol“ im Feld „Wirkstoff“) und Deutschlands, abgerufen am 18. März 2025.


