Eutektikum
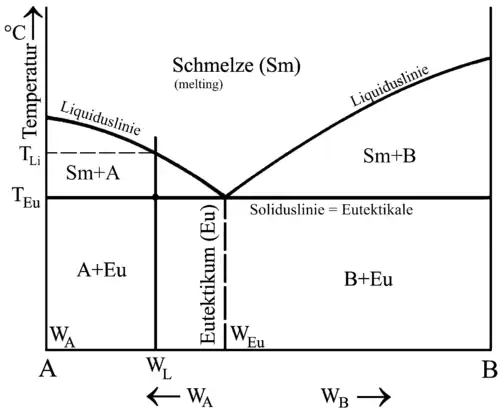
WA: Phase A
WL: eine willkürlich ausgewählte Legierung
WEu: Eutektikum
WB: Phase B
Ein Eutektikum (altgriechisch εὐ eu- gut, τήκω teko schmelzen; Plural Eutektika) ist ein Stoffgemisch oder eine Legierung mit einer Zusammensetzung, so dass die Mischung bei genau einer definierten Temperatur schmilzt oder erstarrt. Diese Eutektikumstemperatur liegt unterhalb der Schmelzpunkte der einzelnen Komponenten.
Die eutektische Zusammensetzung eines Stoffgemischs ist in einem Zustandsschaubild mit den zwei Freiheitsgraden, Temperatur und Anteil der beteiligten Komponenten, zu erkennen.
Eine ähnliche Erscheinungsform, bei der allerdings alle beteiligten Phasen bereits im festen Aggregatzustand vorliegen, nennt man Eutektoid.
Abgrenzung
Im Gegensatz zu Eutektika findet bei nichteutektischen Gemischen der Phasenübergang zwischen der festen und der flüssigen Phase innerhalb eines Temperaturbereichs statt. In diesem liegt jeweils mindestens eine Komponente rein im festen Zustand vor und die anderen Komponenten als Gemisch im festen oder flüssigen Zustand.[1]
Kühlt man beispielsweise eine wässrige, jedoch noch nicht eutektische (untereutektische), Salzlösung ab, so scheiden sich aufgrund der Gefrierpunktserniedrigung des Wassers erst unterhalb von 0 °C die ersten Eiskristalle aus. Bei weiterer Abkühlung fallen immer mehr Eiskristalle aus, die noch nicht kristallisierte Restlösung wird dadurch immer „salziger“. Nachdem der eutektische Punkt erreicht ist, (Salzgehalt gleich der eutektischen Zusammensetzung) kommt es nicht mehr zur Eisbildung, es kristallisieren Salzhydrate aus, und die Temperatur, als auch die Salzkonzentration der Lösung bleibt bis zum vollständigen Erstarren konstant.[2][3][4] Bei übereutektischen Salzlösungen hingegen fällt während des Abkühlens Salz aus, wodurch die Konzentration der verbleibenden Lösung bis zur eutektischen Zusammensetzung sinkt. Ein ähnlicher Effekt wird bei eutektischen Legierungen beobachtet.
Zu unter- beziehungsweise übereuktektischen Legierungen siehe Zweistoffsysteme mit vollständiger Unlöslichkeit im festen Zustand.
Eutektische Legierungen

Eigenschaften
Am eutektischen Punkt, berühren sich Solidus- und Liquiduslinie. Dort sind alle drei Phasen des Systems – Schmelze, Phase A und B – im Gleichgewicht und bei eutektischen Legierungen wechseln alle Stoffe gleichzeitig die Phase von fest auf flüssig. Das bedeutet, eine eutektische Legierung hat einen eindeutig bestimmbaren Schmelzpunkt, den sogenannten eutektischen Punkt Die Erstarrungstemperatur ist zudem die niedrigste aller Mischungen aus den gleichen Bestandteilen.[5]
Weil bei Eutektika alle Bestandteile gleichzeitig erstarren und dies bei einer viel niedrigeren Temperatur geschieht, als es bei den reinen Komponenten der Fall wäre, entsteht ein feines und gleichmäßiges Gefüge, das eine in der Regel charakteristische lamellare Struktur aufweist. Ursache dafür ist die bei dieser Temperatur niedrige Bewegungsenergie der Atome, die nur kurze Wege und damit nur die Bildung sehr kleiner Kristalle (auch Kristallite genannt) zulässt.
Die Gibbssche Phasenregel für Feststoffe bei konstantem Druck lautet . Daraus erhält man für eutektische Legierungen mit zwei Komponenten und drei Phasen (Schmelze, Phase A, Phase B) den Wert , das heißt, die vollkommene Erstarrung des Eutektikums ist nur in einem Punkt möglich.
Verfestigungsmechanismen
Der primäre Verfestigungsmechanismus der eutektischen Struktur in Metallen ist die Verbundwerkstoffverfestigung (siehe Verfestigungsmechanismen von Werkstoffen). Dieser Verformungsmechanismus funktioniert durch Lastübertragung zwischen den beiden konstituierenden Phasen, wobei die nachgiebigere Phase Spannung auf die steifere Phase überträgt.[6] Durch Ausnutzung der Festigkeit der steifen Phase und der Duktilität der nachgiebigen Phase erhöht sich die Gesamtzähigkeit des Materials. Wenn die Zusammensetzung zu untereutektischen oder übereutektischen Formationen variiert wird, wird der Mechanismus der Lastübertragung komplexer, da es nun sowohl eine Lastübertragung zwischen der eutektischen Phase und der sekundären Phase als auch eine Lastübertragung innerhalb der eutektischen Phase selbst gibt.
Ein zweiter einstellbarer Verfestigungsmechanismus eutektischer Strukturen ist der Abstand der Sekundärphase. Durch die Verringerung des Abstands der eutektischen Phase und die Schaffung einer feinen eutektischen Struktur wird mehr Oberfläche zwischen den beiden konstituierenden Phasen geteilt, was zu einer effektiveren Lastübertragung führt.[7] Auf der Mikroskala wirkt die zusätzliche Grenzfläche als Barriere für Versetzungen, wodurch das Material weiter verfestigt wird. Infolge dieses Verfestigungsmechanismus sind grobe eutektische Strukturen tendenziell weniger steif, aber duktiler, während feine eutektische Strukturen steifer, aber spröder sind.[7] Der Abstand der eutektischen Phase kann während der Verarbeitung gesteuert werden, da er direkt mit der Abkühlungsgeschwindigkeit während der Erstarrung der eutektischen Struktur zusammenhängt. Für eine einfache lamellare eutektische Struktur beträgt der minimale Lamellenabstand beispielsweise:[8]
Dabei sind:
- die Oberflächenenergie der Zweiphasengrenze,
- das Molvolumen der eutektischen Phase,
- die Erstarrungstemperatur der eutektischen Phase,
- die Bildungenthalpie der eutektischen Phase und
- die Unterkühlung der eutektischen Phase.
Durch Änderung der Unterkühlung und damit der Abkühlungsgeschwindigkeit wird also der minimal erreichbare Abstand der sekundären Phase gesteuert.
Um Verformungen bei hohen Temperaturen (Kriechverformung) zu verringern, muss beachtet werden, dass sich der primäre Verformungsmechanismus in Abhängigkeit von der Höhe der angelegten Spannung ändert. Bei hohen Temperaturen, bei denen die Verformung durch Versetzungsbewegungen dominiert wird, bleiben die Verstärkung durch Lastübertragung und sekundäre Phasenabstände bestehen, da sie der Versetzungsbewegung weiterhin widerstehen. Bei niedrigeren Spannungen, bei denen das Nabarro-Herring-Kriechen dominiert, spielen Form und Größe der eutektischen Phasenstruktur eine wichtige Rolle, da sie die verfügbare Grenzfläche für die Leerstellendiffusion beeinflussen.[9]
Verwendung
Eisenmetallurgie
Ein technisch häufig genutztes Eutektikum ist z. B. der Ledeburit des Eisen-Kohlenstoff-Systems (4,3 % Kohlenstoff, Schmelzpunkt 1147 °C), das zum Gießen von Temperguss genutzt wird.
Aluminiumherstellung
Auch bei der Herstellung von Aluminium mittels Schmelzflusselektrolyse wird ein eutektisches Gemisch verwendet. Hier wird aus 10,5 % Massenanteil Aluminiumoxid (Al2O3, Schmelzpunkt 2058 °C) und 89,5 % Kryolith (Na3[AlF6], Schmelzpunkt 1012 °C) ein Gemisch mit dem Schmelzpunkt 950 °C hergestellt.[10]
Lötmaterial
Da der Schmelzpunkt einer eutektischen Legierung deutlich unter dem der reinen Metalle liegt, werden solche Legierungen bevorzugt zum Löten verwendet. Dies hat den Vorteil, dass man relativ wenig Wärme einbringen muss und bei der Wahl des Lotes die Materialverwandtschaft von Lot und Fügepartner nutzen kann.
Aluminium-Wolfram
Bringt man Aluminium (Schmelzpunkt 660 °C) und Wolfram (Schmelzpunkt 3422 °C) zusammen, entstehen erst intermetallische Phasen/Verbindungen aus Wolfram und Aluminium. Je nach Stöchometrie entstehen Al12W, Al5W, Al4W oder Al2W. Zwischen diesen entstehen mehrere Legierungen mit einem sehr komplexen Phasendiagramm. Es gibt dabei nur ein lokales Miniumum bei 1652,5 °C, bei dem die Schmelze aus Al4W, Al2W und W besteht. Der molare Anteil an Aluminium liegt bei 10,23 %.[11][12]
Diese Bildung von intermetallischen Verbindungen oder gar chemischen Verbindungen ist die Ursache dafür, dass für das Herstellen von Eutektika mit niedriger Schmelztemperatur es nicht ausreicht, beliebige niedrigschmelzende Stoffe zusammenzukippen. Bilden diese Verbindungen, kommt es so gut wie immer zu einer Erhöhung der Schmelztemperatur. Nur Stoffe mit ähnlichen Eigenschaften lassen sich häufig zu Eutektika verarbeiten.
Weitere Beispiele für diesen Verhalten:
Beispiele von intermetallischen Verbindungen mit eutektischen Punkten:
Zwischenprodukt für die Produktion von Legierungen
Weiterhin nutzt man den herabgesetzten Schmelzpunkt zum Erstellen von Legierungen, bei denen die Schmelzpunkte der beiden Komponenten weit auseinanderliegen.
Kältemischungen
Im chemischen Labor macht man sich die Bildung niedrigschmelzender Eutektika zunutze, um Kältemischungen herzustellen.
Thermometer
Einen besonders niedrigen Schmelzpunkt weist die als Galinstan bekannte eutektische Legierung aus 68 bis 69 % Gallium, 21 bis 22 % Indium und 9,5 bis 10,5 % Zinn auf, die erst bei −19,5 °C kristallisiert und in quecksilberfreien, analogen Fieberthermometern verwendet wird.
Eher von historischer Relevanz ist Thallium-Amalgam Hg91,5Tl8,5, dessen Schmelzpunkt mit −58 °C unterhalb dem von reinem Quecksilber liegt, was historisch genutzt wurde, um besonders tiefe Temperaturen mit analogen Thermometern zu messen. Aufgrund der Giftigkeit sowohl von Thallium als auch von Quecksilber und der Verfügbarkeit anderer Messmethoden werden derartige Thermometer kaum noch verwendet.
Nukleartechnik
Sowohl in Forschungsreaktoren als auch in Reaktoren, deren Hauptzweck die Erzeugung elektrischer Energie oder von Prozesswärme ist, kommen Eutektika als Kühlmittel zum Einsatz.
Der Hauptvorteil flüssiger Metalle als Kühlmittel gegenüber üblichen Leichtwasserreaktoren sind die höheren erzielbaren Betriebstemperaturen. Darüber hinaus sind die meisten Metalle nicht oder nur begrenzt als Neutronenmoderator wirksam, weswegen ein schneller Brüter nicht mit Wasser im Primärkreislauf gekühlt werden kann. Vorteil gegenüber gasgekühlten Reaktoren ist die höhere Dichte und der damit größere Wärmetransportfähigkeit bei gegebenem Volumen.[19]
Übliche Eutektika, welche für entsprechende Reaktoren eingesetzt oder vorgeschlagen werden, sind Blei-Bismut (Schmelztemperatur 123,5 °C) und NaK (Schmelztemperatur −11 °C, siehe weiter unten).[20] Das Forschungsprojekt MYRRHA soll mit Blei-Bismut gekühlt werden.[21]
Bei Bismut bestehen gewisse Probleme mit Neutronenaktivierung (aus Bi-209 entsteht Po-210, zerfällt mit einer HWZ von 4½ Monaten in stabiles Pb-206).
Weniger bei Natrium (aus Na-23 entsteht Na-24, zerfällt mit einer HWZ von 14 Stunden in stabiles Mg-24), dafür ist NaK korrosiv, brennbar und reagiert explosiv mit Wasser.
In für Flüssigsalzreaktoren vorgeschlagenen Salzschmelzen, wie z. B. LiF·BeF2 (Schmelzpunkt nach neueren Quellen 460 °C)[22] oder LiF·NaF·KF (Schmelzpunkt 454 °C), stellen üblicherweise Eutektika dar.[23]
Beispiele
Bekannte Beispiele für eutektische Legierungen sind
- das als „Lötzinn“ bzw. „Sickerlot“ bekannte System aus Zinn (Sn) und Blei (Pb) mit einer Zusammensetzung von 63 % Sn und 37 % Pb mit einer Schmelztemperatur von 183 °C.
- verschiedene Silberlote, die neben Silber (Ag) und Kupfer (Cu) noch Zink (Zn), Zinn (Sn) und Cadmium (Cd) enthalten können. So besteht z. B. das Silberlot „L-Ag44“ aus 44 % Ag, 30 % Cu und 26 % Zn.
- Roses Metall, eine Legierung aus Bismut (Bi), Blei und Zinn mit einem Schmelzpunkt von ca. 94 °C
- Fieldsches Metall ist ein Eutektikum aus Indium (In), Bismut und Zinn und schmilzt bei etwa 62 °C.
- Woodsches Metall (auch Wood’sche Legierung) besteht aus einer eutektischen Legierung im System Bismut-Blei-Cadmium-Zinn, die bei etwa 60 °C schmilzt.
- Eine Natrium-Kalium-Legierung ist bei Raumtemperatur flüssig.
Neben ihrer hauptsächlichen Verwendung als Lötmetalle kommen solche gut schmelzenden Legierungen unter anderem noch in Sprinkleranlagen oder in Scherzartikeln zum Einsatz. Ebenso stellen bestimmte Quarzporphyre oder eine Lösung von 30,9 g Kochsalz auf 100 g Wasser (Kryohydrat, Schmelzpunkt −21,3 °C) Eutektika dar.
Siehe auch
- Peritektikum
- Monotektisch
- Zweistoffsysteme mit vollständiger Unlöslichkeit im festen Zustand
- Dystektikum
Literatur
- Dieter Kohtz: Einführung in die Werkstoffkunde für Metallschweißer. In: Der Praktiker: das Magazin für Schweißtechnik und mehr. 9/1982 bis 1/1985. DVS-Verlag, ISSN 0554-9965.
Weblinks
Einzelnachweise
- ↑ Eutektikum. Deutsche Gesellschaft für Materialkunde (DGM), abgerufen am 8. Mai 2025.
- ↑ Eutektisches Gemisch. Spektrum.de, abgerufen am 8. Mai 2025.
- ↑ Eutektische Sole. Spektrum.de, abgerufen am 8. Mai 2025.
- ↑ Erik Hennings: Cryo brines – Phasengleichgewichte von Salz-Wasser-Systemen bei tiefen Temperaturen. (PDF 12,3 MB) Technischen Universität Bergakademie Freiberg, abgerufen am 8. Mai 2025.
- ↑ Brockhaus ABC Chemie. VEB F. A. Brockhaus Verlag, Leipzig 1965, DNB 450772217, S. 384.
- ↑ T. H. Courtney: Mechanical behavior of materials. 2. Auflage. McGraw-Hill, New York 1990 (englisch).
- ↑ a b William D. Callister, David G. Rethwisch: Materials science and engineering. An Introduction. John Wiley & Sons, 2020, ISBN 978-1-119-32159-0 (englisch, ftp.idu.ac.id [PDF; 14 kB; abgerufen am 8. Mai 2025]).
- ↑ David A. Porter, Kenneth E. Easterling, Mohamed Y. Sherif: Phase Transformations in Metals and Alloys. 4. Auflage. CRC Press, Boca Raton 2021.
- ↑ Tiffany Wu, A. Plotkowski, A. Shyam, David C. Dunand: Microstructure and creep properties of cast near-eutectic Al–Ce–Ni alloys. In: Materials Science and Engineering: A. Band 833, Januar 2022, S. 12, doi:10.1016/j.msea.2021.142551 (englisch).
- ↑ Brockhaus ABC Chemie. VEB F. A. Brockhaus Verlag, Leipzig 1965, DNB 450772217, S. 52–56.
- ↑ https://computherm.com/al-w
- ↑ https://www.rccm.co.jp/factsage/gedb-open/al-elem/alw/alw.html
- ↑ https://www.researchgate.net/figure/Phase-diagram-of-the-copper-zinc-system-17_fig1_257647664
- ↑ https://schematicrazmigamb6t.z21.web.core.windows.net/nickel-aluminium-phase-diagram.html
- ↑ https://www.researchgate.net/figure/Binary-phase-diagram-of-Iron-Aluminium_fig1_260788867
- ↑ https://schempro.com/titanium-alloy-phase-diagram
- ↑ https://himikatus.ru/art/phase-diagr1/Bi-In.php
- ↑ https://www.researchgate.net/figure/Silver-indium-phase-diagram-60_fig3_225404872
- ↑ U.S. Congress, Office of Technology Assessment (Hrsg.): Technical Options for the Advanced Liquid Metal Reactor. U.S. Government Printing Office, Washington, D.C. 1994 (englisch, repository.library.georgetown.edu [PDF; abgerufen am 8. Mai 2025]).
- ↑ Lead and Lead-bismuth Eutectic – Reactor Coolant. In: nuclear-power.com. Abgerufen am 8. Mai 2025.
- ↑ MYRRHA reactor – The lead-bismuth eutectic (LBE) cooled reactor. In: myrrha.be. Abgerufen am 8. Mai 2025.
- ↑ https://www.sciencedirect.com/science/article/pii/S0306454924002949
- ↑ T. Lichtenstein, M. A. Rose, J. Krueger, E. Wu, M. A. Williamson: Thermochemical Property Measurements of FLiNaK and FLiBe in FY 2020. Hrsg.: Argonne National Laboratory. November 2020 (englisch, publications.anl.gov [PDF; 884 kB; abgerufen am 8. Mai 2025]).