Estrogenrezeptor
| Estrogen-Rezeptor, α-Untereinheit | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 595 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer, Heterodimer | |
| Isoformen | Long, Short | |
| Bezeichner | ||
| Gen-Name | ESR1 | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | mehrzellige Tiere | |
| Estrogen-Rezeptor, β-Untereinheit | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 530 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer, Heterodimer | |
| Isoformen | 8 | |
| Bezeichner | ||
| Gen-Name | ESR2 | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Säugetiere | |
Estrogenrezeptoren (ER), auch Östrogenrezeptoren, sind Steroidrezeptoren, die zur Superfamilie der nukleären Rezeptoren NR3I (nuclear receptor subfamily 3, group I) zählen und durch das Steroidhormon Estrogen aktiviert werden.[1] Die wichtigste Funktion des Estrogenrezeptor ist ein DNA-bindender Transkriptionsfaktor, der die Genexpression des Zielgens reguliert. Der Estrogenrezeptor hat jedoch noch zusätzliche Funktionen unabhängig von der DNA-Bindung.[2]
Struktur und Bindung
Zwei humane Rezeptorsubtypen konnten identifiziert werden, die beide die gleiche Grundstruktur besitzen:
- Estrogenrezeptor-α (ERα, NR3A1)
- Estrogenrezeptor-β (ERβ, NR3A2)
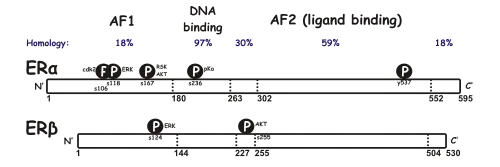
Beide Rezeptoren besitzen sechs Domänen (A–F):
- A/B-Domäne: Enthält eine ligandenunabhängige transkriptionelle Aktivierungsfunktion (AF-1).
- C-Domäne: DNA-Bindungsdomäne (DBD). Sie enthält zwei Zinkfingermotive.
- D-Domäne: Dimerisierungsregion.
- E/F-Domäne: Enthält die Ligandenbindungsdomäne (LBD) und eine sogenannte Transaktivierungsregion am C-Terminus (AF-2).
Da beide Subtypen in vielen Zellen gleichzeitig exprimiert werden, kommt es bei der hormonaktivierten Rezeptordimerisierung zur Bildung von ERα (αα) bzw. ERβ (ββ) Homodimeren oder ERαβ (αβ) Heterodimeren.
Unterschiedliche Liganden können sich in ihrer Affinität hinsichtlich der beiden Rezeptorisoformen unterscheiden:[3]
- Estradiol und Coumestrol bindet an beide Rezeptoren
- Estron und Raloxifen binden vorzugsweise an ERα
- Estriol und Genistein binden an ERβ
Selektive Estrogenrezeptormodulatoren binden vorzugsweise entweder an den α- oder β-Subtyp des Rezeptors.
Die Überlebensrate von Brustkrebspatientinnen korreliert stärker mit den Ergebnissen der immunhistochemischen Färbung des Estrogenrezeptors als mit dem Nachweis der mRNA des Estrogenrezeptors.[4] Patientengruppen mit Tumoren, die den Estrogenrezeptor β, aber nicht den Estrogenrezeptor α aufweisen, haben größere Überlebensraten.[4]
ESR1-Mutation
Das ESR1-Gen ist auf dem Chromosom 6p25.1 lokalisiert und codiert für den Östrogenrezeptor 1 (ERα), der Östrogen bindet und so die Genexpression reguliert.[5] Etwa 70 % aller Brustkrebserkrankungen sind östrogenrezeptor-positiv (ER-positiv). Die Standardtherapie besteht aus endokrinen Therapien (ET), die das Wachstum dieser Tumore durch Hemmung des Östrogensignals verhindern. Ein Problem stellt jedoch die Therapieresistenz dar, die oft durch Mutationen im ESR1-Gen entsteht. Das ESR1-Gen (Estrogen-Rezeptor-1) kodiert für den Östrogenrezeptor (ER-α), der das Tumorwachstum durch Bindung an Östrogen fördert. Mutationen im Ligandenbindungsdomäne (LBD) des ESR1-Gens führen dazu, dass der Rezeptor ständig aktiv bleibt, selbst wenn kein Östrogen vorhanden ist. Dies macht die Tumorzellen resistent gegen Aromatasehemmer (AIs), eine häufige Therapieoption.[6] Die häufigsten und am besten erforschten Mutationen sind Y537S und D538G, die eine permanente Aktivierung des ER-α zur Folge haben. L536Q, Y537C und Y537N sind ebenfalls aktivierende Mutationen, die mit einer erhöhten Metastasierungsrate assoziiert sind. Diese Mutationen verstärken die Tumorprogression und sind ein häufiger Mechanismus für endokrine Resistenz.
Eine Testung auf ESR1 kann mittels Flüssigbiopsien (liquid biopsy; ctDNA-Analyse), Droplet Digital PCR (ddPCR) oder Next-Generation Sequencing (NGS) erfolgen.[7]
Studien zeigen, dass ESR1-Mutationen oft erst bei metastasiertem Brustkrebs auftreten, insbesondere nach Aromatasehemmer-Therapie. Patientinnen mit ESR1-Mutationen sprechen schlechter auf Aromatasehemmer an, jedoch besser auf Fulvestrant (selektiver Östrogenrezeptor-Downregulator, SERD). Elacestrant ist als SERD in der EU seit 2023 zugelassen für postmenopausale Patientinnen und erwachsene Männer mit fortgeschrittenem/metastasiertem Brustkrebs, der Estrogenrezeptor-positiv und ESR1-mutiert ist.[8][9] Das ESR1-Gen spielt vermutlich bei weiteren Tumorerkrankungen wie Lungenkrebs (NSCLC, nichtkleinzelliges Lungenkarzinom) eine Rolle.[10]
Weblinks
- Jennifer McDowall/Interpro: Protein Of The Month: Oestrogen receptors. (engl.)
- Eintrag zu Östrogen-Resistenz-Syndrom. In: Orphanet (Datenbank für seltene Krankheiten)
Einzelnachweise
- ↑ Dahlman-Wright, K. et al. (2006): International Union of Pharmacology. LXIV. Estrogen receptors. In: Pharmacol Rev. 58(4):773-781. PMID 17132854 PDF
- ↑ Levin, E.R. (2005): Integration of the extranuclear and nuclear actions of estrogen. In: Mol Endocrinol. 19(8):1951-1959. PMID 15705661 doi:10.1210/me.2004-0390
- ↑ Morito K, Aomori T, Hirose T, et al: Interaction of phytoestrogens with estrogen receptors alpha and beta (II). In: Biol Pharm Bull. 25. Jahrgang, Nr. 1, Januar 2002, S. 48–52, doi:10.1248/bpb.25.48, PMID 11824555 (englisch).
- ↑ a b W. Tan, Q. Li, K. Chen, F. Su, E. Song, C. Gong: Estrogen receptor beta as a prognostic factor in breast cancer patients: A systematic review and meta-analysis. In: Oncotarget. [elektronische Veröffentlichung vor dem Druck] Februar 2016, doi:10.18632/oncotarget.7219, PMID 26863572.
- ↑ ESR1 Gen - ESR1. 12. Juni 2024, abgerufen am 15. April 2025.
- ↑ Derek Dustin, Guowei Gu, Suzanne A. W. Fuqua: ESR1 mutations in breast cancer. In: Cancer. Band 125, Nr. 21, 1. November 2019, ISSN 1097-0142, S. 3714–3728, doi:10.1002/cncr.32345, PMID 31318440, PMC 6788940 (freier Volltext) – (nih.gov [abgerufen am 12. März 2025]).
- ↑ Konstantinos Venetis, Francesco Pepe, Carlo Pescia, Giulia Cursano, Carmen Criscitiello, Chiara Frascarelli, Eltjona Mane, Gianluca Russo, Beatrice Taurelli Salimbeni, Giancarlo Troncone, Elena Guerini Rocco, Giuseppe Curigliano, Nicola Fusco, Umberto Malapelle: ESR1 mutations in HR+/HER2-metastatic breast cancer: Enhancing the accuracy of ctDNA testing. In: Cancer Treatment Reviews. Band 121, Dezember 2023, ISSN 1532-1967, S. 102642, doi:10.1016/j.ctrv.2023.102642, PMID 37864956 (nih.gov [abgerufen am 12. März 2025]).
- ↑ Elacestrant (Orserdu) bei fortgeschrittenem Brustkrebs. Abgerufen am 12. März 2025 (deutsch).
- ↑ ORSERDU 86 mg Filmtabletten / ORSERDU 345 mg Filmtabletten - PatientenInfo-Service. Abgerufen am 12. März 2025.
- ↑ Unai Aresti, Sergio Carrera, Eluska Iruarrizaga, Natalia Fuente, Ines Marrodan, Abigail Ruiz de Lobera, Alberto Muñoz, Aitziber Buque, Elizabeth Condori, Irene Ugalde, Begoña Calvo, Guillermo López Vivanco: Estrogen receptor 1 gene expression and its combination with estrogen receptor 2 or aromatase expression predicts survival in non-small cell lung cancer. In: PloS One. Band 9, Nr. 10, 2014, ISSN 1932-6203, S. e109659, doi:10.1371/journal.pone.0109659, PMID 25310221, PMC 4195686 (freier Volltext) – (nih.gov [abgerufen am 15. April 2025]).