Epoxyeicosatriensäuren
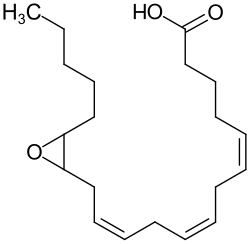
Epoxyeicosatriensäuren (EET) stellen eine Klasse bioaktiver Lipidmediatoren dar, die durch enzymatische Epoxidierung der Arachidonsäure mittels spezifischer Cytochrom-P450-Epoxygenasen entstehen und als wichtige Signalmoleküle in verschiedenen physiologischen Prozessen fungieren. Diese Verbindungen weisen ein breites Spektrum biologischer Aktivitäten auf, darunter gefäßerweiternde, entzündungshemmende und kardioprotektive Eigenschaften, die sie zu bedeutsamen Regulatoren der Herz-Kreislauf-Funktion, der Nierenfunktion und der Neuroprotektion machen. Die therapeutische Bedeutung der EET wird durch ihre schnelle Metabolisierung durch die lösliche Epoxidhydrolase (sEH) reguliert, weshalb die Hemmung dieses Enzyms als vielversprechender Ansatz für die Behandlung verschiedener Erkrankungen erforscht wird.
Biochemie und Synthese
Grundlagen der EET-Biosynthese
Die Epoxyeicosatriensäuren (EET) sind biologisch aktive Signalmoleküle, die als nicht-klassische Eicosanoide durch den enzymatischen Metabolismus der Arachidonsäure entstehen.[1] Die Biosynthese der EET erfolgt über den Cytochrom-P450-Stoffwechsel, bei dem spezifische Cytochrom-P450-Epoxygenasen die Arachidonsäure als Substrat verwenden.[2] Arachidonsäure, eine mehrfach ungesättigte Omega-6-Fettsäure mit vier cis-Doppelbindungen zwischen den Kohlenstoffatomen 5 und 6, 8 und 9, 11 und 12 und 14 und 15, wird zunächst durch die Aktivität von Phospholipase-A2-Enzymen aus der sn-2-Position von Membranphospholipiden freigesetzt.[3] Diese kann über drei Hauptmetabolisierungswege verstoffwechselt werden: über die Cyclooxygenase zu Prostaglandinen und Thromboxan, über die Lipoxygenase zu Leukotrienen und über Cytochrom-P450-Enzymen zu Epoxyeicosatriensäuren und Hydroxyeicosatetraensäuren.[4]
Epoxidierungsprozess
Die Cytochrom-P450-Epoxygenasen katalysieren die Insertion eines Sauerstoffatoms an die Kohlenstoff-Kohlenstoff-Doppelbindungen der Arachidonsäure, wobei die Doppelbindung während der Epoxidbildung reduziert wird. Dieser Epoxidierungsprozess führt zur Entstehung von vier strukturellen Regioisomeren: 5,6-EET (5,6-Epoxy-8Z,11Z,14Z-eicosatriensäure),[S 1] 8,9-EET (8,9-Epoxy-5Z,11Z,14Z-eicosatriensäure),[S 2] 11,12-EET (11,12-Epoxy-5Z,8Z,14Z-eicosatriensäure)[S 3] und 14,15-EET (14,15-Epoxy-5Z,8Z,11Z-eicosatriensäure).[S 4] Jedes Regioisomer existiert als Mischung zweier enantiomerer Formen in unterschiedlichen Proportionen, da die Epoxygenasen sowohl R- als auch S-Enantiomere an jeder ehemaligen Doppelbindungsposition bilden. Beispielsweise metabolisieren Cytochrom-P450-Epoxidasen die Arachidonsäure zu einer Mischung aus 14R,15S-EET[S 5] und 14S,15R-EET.[S 6][2][5]
Cytochrom-P450-Enzyme
Die hauptsächlich an der EET-Biosynthese beteiligten Cytochrom-P450-Enzyme gehören zu verschiedenen Unterfamilien, einschließlich CYP1A, CYP2B, CYP2C, CYP2E, CYP2J und innerhalb der CYP3A-Unterfamilie CYP3A4. Beim Menschen sind CYP2C8, CYP2C9, CYP2C19, CYP2J2 und möglicherweise CYP2S1 die Hauptproduzenten von EET, obwohl auch CYP2C18, CYP3A4, CYP4A11, CYP4F8 und CYP4F12 zur EET-Produktion fähig sind und dies in bestimmten Geweben tun können. Die CYP-Epoxygenasen können jede der Doppelbindungen in der Arachidonsäure epoxidieren, sind jedoch relativ selektiv, da sie nennenswerte Mengen von nur einem oder zwei EET produzieren, wobei 11,12-EET und 14,15-EET 67 bis 80 % des Produkts der genannten CYP-Epoxidasen ausmachen. CYP2C9 fungiert als Hauptproduzent von EET in vaskulären Endothelzellen, während CYP2J2 in hohem Maße in Herzmuskel, Nieren, Bauchspeicheldrüse, Lunge und Gehirn exprimiert wird, jedoch weniger katalytisch aktiv ist als CYP2C.[5]
Regulation und Metabolismus
Die Synthese von EET wird typischerweise durch die Stimulation spezifischer Zelltypen ausgelöst, wobei die Stimulation die Freisetzung von Arachidonsäure aus der sn-2-Position zellulärer Phospholipide durch die Wirkung von Phospholipase-A2-Enzymen und den nachfolgenden Angriff der freigesetzten Arachidonsäure durch eine CYP-Epoxygenase verursacht. Die Cytochrom-P450-Epoxygenasen sind, ähnlich wie praktisch alle CYP450-Enzyme, am Metabolismus verschiedener Xenobiotika und natürlicher Verbindungen beteiligt, und da viele dieser Verbindungen auch Erhöhungen der Epoxygenase-Spiegel induzieren, variieren die CYP-Oxygenase-Spiegel und folglich die EET-Spiegel beim Menschen stark und sind stark abhängig vom jüngsten Konsum. Die gebildeten EET werden durch eine cytoplasmatische lösliche Epoxidhydrolase (sEH) schnell metabolisiert, die Wasser über das Epoxid addiert, um die entsprechenden vicinalen Diol-Dihydroxyeicosatriensäuren zu bilden.[5][2]
Übersicht über die EET-Regioisomere
| EET-Regioisomer | Hauptproduzierende Enzyme | Hauptmetabolit | Besondere Eigenschaften |
|---|---|---|---|
| 5,6-EET | CYP2C8, CYP2C9 | 5,6-DHET | Nicht von sEH metabolisiert, hauptsächlich via COX-2 |
| 8,9-EET | CYP2C8, CYP2C9, CYP2J2 | 8,9-DHET | Starke angiogene Wirkung, TRPA1-Aktivierung |
| 11,12-EET | CYP2C8, CYP2C9, CYP2J2 | 11,12-DHET | Starke Vasodilatation, β-Oxidation zu kürzeren Metaboliten |
| 14,15-EET | CYP2C8, CYP2C9, CYP2J2 | 14,15-DHET | Am besten untersuchte EET, starke kardioprotektive Wirkung |
Physiologische Funktionen und klinische Bedeutung
Kardiovaskuläre Wirkungen
Im kardiovaskulären System fungieren EET als endothelabhängige hyperpolarisierende Faktoren (EDHF) und vermitteln gefäßerweiternde Wirkungen durch Aktivierung calciumabhängiger Kaliumkanäle in glatten Gefäßmuskelzellen.[6][7] Diese Hyperpolarisation führt zu einer Reduktion der intrazellulären Calciumkonzentration und konsekutiver Vasodilatation.[8] Die vasodilatatorische Potenz der EET zeigt eine gefäßgrößenabhängige Verteilung, wobei kleine Widerstandsgefäße eine höhere Sensitivität aufweisen als große Leitungsarterien.[9][7] Experimentelle Studien an isolierten Koronararterien verschiedener Spezies dokumentieren, dass EET endothelunabhängige relaxierende Effekte auf die glatte Gefäßmuskulatur ausüben.[9] Die vaskulären Wirkungen werden sowohl durch direkte Aktivierung von ATP-sensitiven Kaliumkanälen als auch über G-Protein-gekoppelte Rezeptormechanismen vermittelt.[8][7]
Antihypertensive Eigenschaften
EET demonstrieren ausgeprägte antihypertensive Eigenschaften in verschiedenen experimentellen Hypertonie-Modellen.[6] Die pharmakologische Inhibition der löslichen Epoxidhydrolase (sEH) führt zu einer signifikanten Blutdrucksenkung bei Angiotensin-II-induzierter Hypertonie durch verstärkte renale Natrium- und Wasserausscheidung sowie negative chronotrope Herzeffekte.[10] Genetisch veränderte sEH-Knockout-Mäuse weisen basal niedrigere Blutdruckwerte und erhöhte EET-Spiegel auf. In spontan hypertensiven Ratten ist die sEH-Expression signifikant gesteigert, während die Inhibition der sEH-Aktivität die Entwicklung der Hypertonie unterdrückt.[6]
Angiogenetische Aktivität
Die angiogenetischen Eigenschaften der EET manifestieren sich durch Förderung der Endothelzellproliferation und Gefäßneubildung über Aktivierung der PI3K/AKT- und MAPK-Signaltransduktionskaskaden.[7] EET stimulieren die Expression angiogenetischer Wachstumsfaktoren einschließlich des vaskulären endothelialen Wachstumsfaktors (VEGF), des Fibroblasten-Wachstumsfaktors 2 und des epidermalen Wachstumsfaktors. Der COX-2-Metabolit 8,9,11-EHET zeigt besonders potente angiogenetische Aktivität und fördert die Expression von VEGF-Rezeptoren.[11]
Neuroprotektive Wirkungen
Im zentralen Nervensystem üben EET neuroprotektive Wirkungen aus, die sich in der Regulation neuronaler Erregbarkeit, Steigerung der zerebralen Durchblutung und Hemmung neuronaler Apoptose manifestieren. Spezifisch 11,12-EET induziert eine hyperpolarisierende Kaliumleitfähigkeit in CA1-Pyramidenzellen des Hippocampus durch Aktivierung von G-Protein-gekoppelten einwärtsgleichrichtenden Kaliumkanälen (GIRK), was zu einer reduzierten neuronalen Erregbarkeit führt. Diese Mechanismen tragen zur antikonvulsiven Wirkung der EET bei epileptischen Anfällen bei.[12][13]
Antiinflammatorische Eigenschaften
Die antiinflammatorischen Eigenschaften der EET zeigen sich in verschiedenen Krankheitsmodellen durch Reduktion proinflammatorischer Zytokine und Chemokine.[14][7] In experimentellen Modellen systemischen Lupus erythematodes reduziert die Behandlung mit EET-Analoga die renale Expression von CXC-Chemokinrezeptoren und -chemokinen sowie die mRNA-Expression von TNF-α-, IL-6-, IL-1β- und IFN-γ um 70 bis 80 %.[15] EET attenuieren die Neointima-Bildung in Gefäßverletzungsmodellen und reduzieren die Expression inflammatorischer Marker wie Gro-β und COX-2.[14]
Kardiale Pathophysiologie
In der kardialen Pathophysiologie demonstrieren EET protektive Effekte bei Herzinsuffizienz und Myokardinfarkt.[16] Die Behandlung mit EET-Analoga verbessert die Fraktionsverkürzung nach Myokardinfarkt, erhöht die Hämoxygenase-1-Immunreaktivität in Kardiomyozyten und reduziert kardiale Inflammation und Fibrose.[17] Bei adipositas-induzierter Kardiomyopathie modulieren EET die Wnt1-, NOV- und HO-1-Signalwege und verbessern die mitochondriale Integrität sowie thermogene Genexpression.[16]
Therapeutische Bedeutung
Die therapeutische Bedeutung der EET wird durch die Entwicklung von sEH-Inhibitoren und synthetischen EET-Analoga unterstrichen, die als pharmakologische Zielstrukturen für die Behandlung von Hypertonie, Atherosklerose und inflammatorischen Erkrankungen erforscht werden.[10][17][15] Die Identifizierung spezifischer EET-Rezeptoren als G-Protein-gekoppelte Rezeptoren eröffnet weitere therapeutische Ansätze für die gezielte Modulation EET-vermittelter Signalwege.[7]
Funktionsübersicht von Epoxyeicosatriensäuren
| Organsystem | Funktion/Wirkung | Wirkmechanismus | Klinische Relevanz |
|---|---|---|---|
| Kardiovaskuläres System | Vasodilatation und Blutdrucksenkung | Aktivierung von BKCa-Kanälen, EDHF-Wirkung | Zielstruktur für Antihypertensiva |
| Kardioprotektive Wirkung bei Ischämie | Reduktion oxidativen Stresses, Apoptosehemmung | Therapieansatz bei Herzinfarkt | |
| Niere | Natriurese und Diurese | Hemmung der Na-K-ATPase, Kaliumkanalaktivierung | Behandlung von Hypertonie |
| Schutz vor Nephrotoxizität | Antioxidative und antiinflammatorische Effekte | Schutz vor Arzneimittelnephrotoxizität | |
| Nervensystem | Neuroprotektive Wirkung | Mikrogliamodulation, Reduktion von Neuroinflammation | Potential bei neurodegenerativen Erkrankungen |
| Modulation der Schmerzwahrnehmung | TRPA1-Kanalaktivierung, CGRP-Freisetzung | Schmerztherapie, Analgetika-Entwicklung | |
| Immunsystem | Antiinflammatorische Wirkung | NF-κB-Hemmung, Reduktion von Zytokinen | Entzündungshemmende Therapien |
| Angiogenese | Förderung der Blutgefäßneubildung | VEGF-Induktion, Endothelzellproliferation | Wundheilung, aber auch Tumorförderung |
| Krebs/Tumoren | Tumorwachstum und Metastasierung | MMP-Aktivierung, EGFR-Transaktivierung | Potentielles Ziel der Krebstherapie |
Einzelnachweise
- ↑ Walter F. Boron: Medical Physiology. Elsevier Saunders, Philadelphia 2003, ISBN 1-4160-2328-3, S. 106–108.
- ↑ a b c Arthur A. Spector: Arachidonic acid cytochrome P450 epoxygenase pathway. In: Journal of Lipid Research. Jg. 50, Suppl. Bethesda 2009, S. S52–S56, doi:10.1194/jlr.R800038-JLR200.
- ↑ Stefania Tacconelli, Paola Patrignani: Inside epoxyeicosatrienoic acids and cardiovascular disease. In: Frontiers in Pharmacology. Jg. 5. Lausanne 2014, doi:10.3389/fphar.2014.00239.
- ↑ Vanessa Witzel: Einfluss des CYP 2C9-Genotyps auf die Endothelfunktion und auf kardiovaskuläre Erkrankungen. Berlin 2007, Kap. I (fu-berlin.de [PDF]).
- ↑ a b c Arthur A. Spector, Hee-Yong Kim: Cytochrome P450 epoxygenase pathway of polyunsaturated fatty acid metabolism. In: Biochimica et Biophysica Acta: BBA. Molecular and Cell Biology of Lipids. Band 1851, Nr. 4. Amsterdam 2015, S. 356–365, doi:10.1016/j.bbalip.2014.07.020.
- ↑ a b c Alexandra Rueben: Bedeutung von Epoxyeicosatriensäuren für das endotheliale Calciumsignalling. Frankfurt 2006 (uni-frankfurt.de [PDF]).
- ↑ a b c d e f Sandra L. Pfister et al.: Vascular Pharmacology of Epoxyeicosatrienoic Acids. In: Paul M. Vanhoutte, S. J. Enna (Hrsg.): Cardiovascular Pharmacology: Endothelial Control. Elsevier, Amsterdam 2010, ISBN 978-0-12-385061-4, S. 27–59, doi:10.1016/B978-0-12-385061-4.00002-7.
- ↑ a b William B. Campbell, Ingrid Fleming: Epoxyeicosatrienoic Acids and Endothelium-Dependent Responses. In: Pflügers Archiv. Band 459, Nr. 6. Berlin 2010, S. 881–895, doi:10.1007/s00424-010-0804-6.
- ↑ a b Christine L. Oltman et al.: Epoxyeicosatrienoic Acids and Dihydroxyeicosatrienoic Acids Are Potent Vasodilators in the Canine Coronary Microcirculation. In: Circulation Research. Band 83, Nr. 9. Baltimore 1998, S. 932–939, doi:10.1161/01.RES.83.9.932.
- ↑ a b Oliver Jung et al.: Soluble Epoxide Hydrolase Is a Main Effector of Angiotensin II–Induced Hypertension. In: Hypertension. Jg. 45, Nr. 4. Baltimore 2005, S. 759–765, doi:10.1161/01.HYP.0000153792.29478.1d.
- ↑ Amy A. Rand et al.: Epoxyeicosatrienoic acid (EET)-stimulated angiogenesis is mediated by epoxy hydroxyeicosatrienoic acids (EHETs) formed from COX-2. In: Journal of Lipid Research. Jg. 60, Nr. 12. Bethesda 2019, S. 1996–2005, doi:10.1194/jlr.M094219.
- ↑ Lai Wang et al.: Neuroprotective effects of epoxyeicosatrienoic acids. In: Prostaglandins & Other Lipid Mediators. Band 138. New York 2018, S. 9–14, doi:10.1016/j.prostaglandins.2018.07.002.
- ↑ Nandkishor K. Mule et al.: 11,12-Epoxyeicosatrienoic acid (11,12 EET) reduces excitability and excitatory transmission in the hippocampus. In: Neuropharmacology. Band 123. Orlando 2017, S. 310–321, doi:10.1016/j.neuropharm.2017.05.013.
- ↑ a b Marc Revermann et al.: Soluble epoxide hydrolase deficiency attenuates neo-intima formation in the femoral cuff model of hyperlipidemic mice. In: Arteriosclerosis, Thrombosis, and Vascular Biology. Jg. 30, Nr. 5. Hagerstown 2010, S. 909–914, doi:10.1161/ATVBAHA.110.204099.
- ↑ a b Abdul Hye Khan et al.: Epoxyeicosatrienoic Acid Analog EET-A Blunts Development of Lupus Nephritis in Mice. In: Frontiers in Pharmacology. Jg. 10. Lausanne 2019, doi:10.3389/fphar.2019.00512.
- ↑ a b Jian Cao et al.: EET intervention on Wnt1, NOV, and HO-1 signaling prevents obesity-induced cardiomyopathy in obese mice. In: American Journal of Physiology: Heart and Circulatory Physiology. Band 313, Nr. 2. Bethesda 2017, S. H368–H380, doi:10.1152/ajpheart.00093.2017.
- ↑ a b Jan Neckář et al.: Epoxyeicosatrienoic acid analog EET-B attenuates post-myocardial infarction remodeling in spontaneously hypertensive rats. In: Clinical Science. Band 133, Nr. 8. London, S. 939–951, doi:10.1042/CS20180728.
Externe Links zu erwähnten Verbindungen
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 5,6-Epoxy-8Z,11Z,14Z-eicosatriensäure: CAS-Nr.: 184488-43-5, PubChem: 5283202, ChemSpider: 4446323, Wikidata: Q27073967.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 8,9-Epoxy-5Z,11Z,14Z-eicosatriensäure: CAS-Nr.: 184488-44-6, PubChem: 5283203, ChemSpider: 4446324, Wikidata: Q27104286.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 11,12-Epoxy-5Z,8Z,14Z-eicosatriensäure: CAS-Nr.: 200960-01-6, PubChem: 5283204, ChemSpider: 4446325, Wikidata: Q27104280.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 14,15-Epoxy-5Z,8Z,11Z-eicosatriensäure: CAS-Nr.: 197508-62-6, PubChem: 5283205, ChemSpider: 4446326, Wikidata: Q27115853.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 14R,15S-EET: CAS-Nr.: 74868-37-4, Wikidata: Q134691066.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 14S,15R-EET: CAS-Nr.: 98103-48-1, PubChem: 5283201, ChemSpider: 4446322, Wikidata: Q106038755.