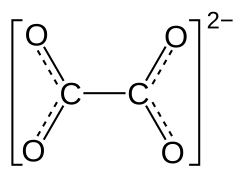
Eisen(II)-oxalat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Eisen(II)-oxalat | |||||||||||||||
| Andere Namen |
Ferrooxalat | |||||||||||||||
| Summenformel | FeC2O4 | |||||||||||||||
| Kurzbeschreibung |
gelbes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 143,85 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,28 g·cm−3 (Dihydrat)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Eisen(II)-oxalat ist ein Eisensalz der Oxalsäure.
Vorkommen
-oxalat-Dihydrat.jpg)
Natürlich kommt Eisen(II)-oxalat-dihydrat als äußerst seltenes Mineral Humboldtin (nach Friedrich Heinrich Alexander von Humboldt) vor.[5]
Gewinnung und Darstellung
Eisen(II)-oxalat kann durch die Reaktion von wässrigen Eisen(II)-salzlösungen mit Oxalsäure oder Alkalioxalaten hergestellt werden.[6]
Eigenschaften
Eisen(II)-oxalat bildet blassgelbe, rhombische Kristalle. Das Dihydrat kommt in zwei verschiedenen (monoklin und orthorhombisch) Kristallformen vor.[7][8]
Wird Eisen(II)-oxalat auf über 190 °C erhitzt, so erhält man die sogenannte Wüstit-Phase[9] , ein schwarzes Eisenoxid-Produkt, das einen mehr oder minder großen Eisenunterschuss gegenüber der Formel FeO aufweist. Nachfolgend die Gleichung dieser Reaktion:
- .
- Eisenoxalat zerfällt bei Erhitzung zu → Eisen(II)-oxid + Kohlenstoffmonoxid + Kohlenstoffdioxid
Unter bestimmten Bedingungen kann über diese Reaktion auch stöchiometrisches Eisen(II)-oxid dargestellt werden (siehe hier).
Verwendung
Verwendung findet Eisen(II)-oxalat seit 1879 in der Analogfotografie als Entwickler.[10] Es wird weiterhin für optische Gläser verwendet.[11] Es eignet sich auch zur Herstellung von pyrophorem Eisen. Mit Kupfersulfat kann es zu Kupfer(II)-oxalat umgesetzt werden.[6]
Literatur
- R. Zboril, L. Machala u. a.: Structural, magnetic and size transformations induced by isothermal treatment of ferrous oxalate dihydrate in static air conditions. In: physica status solidi. 1, 2004, S. 3583, doi:10.1002/pssc.200405511.
- William Allen Miller: Elements of chemistry: theoretical and practical, Band 2 (eingeschränkte Vorschau in der Google-Buchsuche)
Einzelnachweise
- ↑ a b c d Datenblatt Eisen(II)-oxalat (Dihydrat) bei Alfa Aesar, abgerufen am 7. Januar 2010 (Seite nicht mehr abrufbar).
- ↑ tradekorea.com: Ferrous oxalate, battery grade, abgerufen am 3. März 2019.
- ↑ a b Eintrag zu Eisen(II)-oxalat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag salts of oxalic acid with the exception of those specified elsewhere in this Annex in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 12. Juni 2025. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ mineralienatlas.de: Humboldtin (mindat).
- ↑ a b Patent US3846460A: Method of Manufacturing Copper Oxalate. Angemeldet am 25. April 1973, veröffentlicht am 5. November 1974, Anmelder: Cities Service Co, Erfinder: C Fite.
- ↑ I. Sledzinska and A. Murasik: Nuclear and magnetic diffuse scattering of neutrons from β-ferrous oxalate dihydrate, in: Journal of Applied Crystallography, 1988, 21 (5), 504–511; doi:10.1107/S0021889888005758.
- ↑ F. Aramu, V. Maxia, C. Muntoni: Mössbauer spectroscopy of polymorphous iron oxalate. In: Hyperfine Interactions. 5, 1977, S. 399, doi:10.1007/BF01021710.
- ↑ A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 37.–39. Auflage. Walter de Gruyter, Berlin 1956, S. 534.
- ↑ Sir William De W. Abney: Instruction in Photography (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ Schott: Spektroskopische Untersuchungen.
