Krabben
| Krabben | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Krabben (Brachyura) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Brachyura | ||||||||||||
| Latreille, 1802 |
Die Krabben (Brachyura, von altgriechisch βραχύς brachys, deutsch ‚kurz‘ und ουρά ourá, deutsch ‚Schwanz‘, also wörtlich ‚Kurzschwänze‘) – auch Echte Krabben oder Kurzschwanzkrebse – sind mit etwa 7.000 Arten die größte und auch vielgestaltigste Teilordnung der Zehnfußkrebse (Decapoda). Typische Merkmale sind das kurze Rückenschild (Carapax) und ein stark reduzierter Hinterleib (Pleon), der nach vorn umgeschlagen bauchseitig unter dem Rückenschild liegt. Das erste Beinpaar liegt vor dem Körper und trägt Scheren (Chelae). Das zweite bis fünfte Beinpaar ragt seitlich über den seitlichen Körperrand. Sie dienen als Schreitbeine. Krabben besiedeln die meisten Meeresregionen, einige auch Süßwassergebiete in den Tropen und Subtropen, wenige sind überwiegend an Land zu finden. Einige Arten wurden durch den Menschen aktiv oder passiv in neue Gebiete verbracht und konnten sich dort als Neozoen bzw. invasive Arten etablieren und ausbreiten. Krabben sind meist Allesfresser (Omnivoren).
Krabben vermehren sich geschlechtlich. Bei den Männchen sind die ersten beiden Beinpaare des Pleons (Pleopoden) zu Begattungsorganen (Gonopoden) umgewandelt. Weibchen tragen die befruchteten Eier mit den Pleopoden bis zum Schlupf der Larven an ihrer Unterseite. In der Entwicklung vollziehen die meisten Krabben mehrmals einen deutlichen Gestaltwandel (Metamorphose). Die Zoea-Larve ist die Planktonphase der Krabbenentwicklung, ihr folgt meist eine Megalopa und schließlich ein Nachlarvenstadium (Postlarve).
Krabben entstanden im Karbon (vor etwa 300 Millionen Jahren) und spalteten sich im späten Trias in die Hauptlinien auf. Die meisten heutigen Familien und Überfamilien entstanden in der späten Kreidezeit und im frühen Tertiär. Die Süßwasserkrabben spalteten sich vor etwa 135 Millionen Jahren von ihren engsten Verwandten ab.
Krabben werden wegen ihres schmackhaften und ernährungsphysiologisch hochwertigen Fleisches in den Scheren seit langer Zeit als Nahrungsmittel verwendet. In jüngerer Zeit werden sie, vor allem in Ost- und Südostasien, auch in großem Stil in Aquakulturen gezüchtet. Die lange Tradition des Krabbenfangs und ihre kulinarische Bedeutung spiegeln sich auch in zahlreichen Darstellungen von Krabben in der Kunst wider.
Merkmale

Krabben haben, trotz ihrer Artenfülle, einen über die gesamte Gruppe sehr ähnlichen Körperbau mit einem breiten und flachen Rückenschild (Carapax), der den Kopf- und Brustabschnitt der Tiere, den Cephalothorax, umfasst, und einem sehr kleinen, unter dem Carapax eingeschlagenen Hinterleib (Pleon). Sie sind in ihrem Habitus allerdings vielfältiger als andere Taxa der Zehnfußkrebse.[1] Krabben können in ihrer Größe stark variieren und die Körpergrößen reichen von Arten mit einem nur wenige Millimeter breiten Rückenschild wie Neorhynchoplax minima und Lucascinus keijibabai[2] bis hin zur Japanischen Riesenkrabbe (Macrocheira kaempferi) mit einer Rückenschild-Breite von fast 40 Zentimetern und einer Spannweite der ausgestreckten Beine von bis zu 3,70 Metern. Mit einer Masse von bis zu 20 Kilogramm ist sie nicht nur die schwerste Art der Krabben, sondern auch größter und schwerster Gliederfüßer überhaupt. Die ebenfalls sehr große Tasmanische Riesenkrabbe (Pseudocarcinus gigas) ist mit 46 Zentimeter Panzerbreite und bis zu 14,5 Kilogramm Gewicht zwar etwas kleiner als die Japanische Riesenkrabbe, ihre massive Schere ist allerdings so lang wie der Unterarm eines erwachsenen Menschen und damit die größte aller bekannten Krabbenscheren.[1]
Es gibt eine Reihe von Verwandtschaftsgruppen innerhalb der Krebse, die Krabben zum Verwechseln ähnlich sehen, aber nicht näher mit ihnen verwandt sind. Die Körperform, mit untergeschlagenem Pleon, ist offenbar mehrfach konvergent erworben worden. Dieser Prozess wird als Carzinisierung bezeichnet.
Allgemeiner Aufbau und Körperbau
Wie andere Gliederfüßer haben Krabben einen Körper, der aus einer zusammenhängenden Reihe von gelenkig verbundenen Abschnitten (Somiten) besteht, also segmentiert ist. Diese Somiten sind zu funktionellen Einheiten zusammengefasst, die als Tagmata bezeichnet werden. Bei der Verschmelzung einzelner Somiten, wie im Fall der Kopfsomiten, gehen alle Gelenkverbindungen zwischen diesen verloren. Alle Segmente besitzen zumindest während der Entwicklung ein Paar Anhänge bzw. Extremitäten; einige können verloren gehen wie bei den Krabben die meisten Hinterleibsanhänge (Pleopoden).[3] Die vorderste Struktur des Kopfes ist das Acron, das die Augen und eine vordere Verlängerung des Gehirns trägt und kein echter Somit ist. Hierauf folgen fünf verschmolzene Kopfsomiten, die den Kopf (Cephalon) bilden. Auf den Kopf folgt der Thorax bzw. Peraeon mit den Somiten 6 bis 13 und darauf das Abdomen oder Pleon mit den Somiten 14 bis 19. Der letzte Abschnitt des Abdomens, das Schwanzstück (Telson) ist wieder unsegmentiert. Sowohl das bauchseitige (ventrale) Nerven- wie auch das rückenseitige (dorsale) Blutgefäßsystem ziehen sich durch die Segmente vom Kopf bis zum Ende des Pleon, beide reichen jedoch nicht bis in das Telson.[3] Bei den basalen Höheren Krebsen wird traditionell davon ausgegangen, dass sie acht Thorax- und sieben Abdominal-Somiten vor dem Telson haben, während bei der Unterklasse Eumalacostraca, zu der auch die Krabben gehörten, der siebte Abdominal-Somit durch Verschmelzung mit dem sechsten verloren ging.[3]
Die typische Krabbenform entstand durch eine deutliche Verkürzung und Verdickung des Hinterleibes. Dieser liegt bauchwärts nach vorn eingefaltet unter dem Cephalothorax, den verschmolzenen Kopf- und Thoraxsomiten, welche den Hauptteil des Körpers bilden. Die Uropoden am Hinterleibsende fehlen den meisten Krabben.[4][5] Der Cephalothorax ist verkürzt, verbreitert und vertikal (dorsoventral) abgeflacht. Auch der Kopf wird verkürzt und ist als solcher nicht mehr vom übrigen Körper abgesetzt.[4] Wie alle Gliederfüßer haben Krabben ein Exoskelett bzw. eine Cuticula, die bei den meisten Krabben durch Kalkeinlagerung verstärkt und gehärtet ist. Sie stützt den Körper, bietet Schutz und Widerstand gegen Austrocknung und mechanische Einwirkungen und bietet eine Oberfläche für die Befestigung der Muskeln an der Innenseite. Die äußere dünne und wachsartige Epikutikula sorgt für die Wasserdichtigkeit. Sie besteht aus Fasern des langkettigen Polysaccharids Chitin, die mit Proteinen umhüllt sind. Die darunter liegende dicke Prokutikula, die etwa 90 % des Volumens des Exoskeletts ausmacht, dient in erster Linie dazu, mechanischen Belastungen und Spannungen standzuhalten.[6]
Die bauchseitigen Chitinplatten der Brustsegmente (Sterniten) sind zu einem Brustpanzer (Sternum) verschmolzen. Auch die rückenseitigen Schilde (Tergite) sind zu einem gemeinsamen Rückenpanzer, dem Carapax, verschmolzen, der den gesamten Cephalothorax umfasst. Der Seitenrand des Carapax wird in einen vorderen und hinteren Abschnitt unterteilt. Er kann Auswüchse in Form von Dornen, Zähnen oder Lappen tragen, die zur taxonomischen Zuordnung verwendet werden.[1]
Kopf und Mundwerkzeuge

Die Kopfsomiten sind zu einer Einheit ohne Segmentgrenzen verschmolzen. Im vordersten Bereich, dem Acron, befindet sich der vorderste Teil des Gehirns und auch die Augen entspringen hier.[7] Sie dienen der visuellen Wahrnehmung und ergänzen so andere Sinne wie die Chemowahrnehmung durch die Antennen. Sie sind wie bei anderen Krebstieren Facettenaugen, die aus zahlreichen Einzelaugen (Ommatidien) zusammengesetzt und von einer Hornhaut überdeckt sind. Sie können bei einigen Höhlen- und Tiefsee-Arten und auch bei Arten, die in relativ flachem Wasser in schlammigem Boden leben, erheblich reduziert sein oder fehlen. Bei den meisten Krabben sind sie auf beweglichen Augenstielen platziert.[7]

Die Augenstiele bestehen aus zwei Teilen, einem Basalstiel (Basophthalmit) und dem eigentlichen Augenstiel (Podophthalmit), wobei letzterer in der Regel deutlich länger und ausgeprägter ist. Bei einer Reihe von Familien und Gattungen gibt es eine deutliche Tendenz zu mäßig bis sehr langen Augenstielen, vor allem bei nicht räuberischen und grabenden Arten, die in flachen Gebieten mit weichen Sedimenten leben.[7] Am Ansatz der Augenstiele befinden sich die Augenhöhlen, die in ihrer Form sehr variabel sind.[8] Im Normalfall handelt es sich um ein Paar eiförmiger bis querverlaufender länglicher, oft tiefer seitlicher Vertiefungen, in denen die Augenstiele im eingezogenen Zustand zumindest teilweise geschützt sind. Der obere Augenhöhlenrand geht in die Stirn über und wölbt sich in der Regel seitlich nach außen, um auf den Unteraugenhöhlenrand zu treffen. An der Verbindungsstelle befindet sich häufig ein Fortsatz, der als äußerer Orbitalzahn oder Exorbitalzahn bezeichnet wird. Darunter kann der Rand der Augenhöhle durchgängig, durch eine seitliche Furche unterbrochen oder weit offen sein. Der innere Rand des Unteraugenhöhlenrandes endet in der Regel vor der Basis des Auges oder der Antennen, so dass am inneren Ende der Augenhöhle eine deutliche Lücke entsteht, in die die Antennengeißel eingelegt werden kann.[8] Die Augenhöhlen können schwach ausgeprägt sein oder sogar fehlen wie etwa bei den Latreilliidae, Retroplumoidea, Dorippidae, Hymenosomatoidea oder Majoidea, so dass die Augen vollständig freiliegen. Bei den Homolodromioiden liegen die Augen und die beiden Antennen in einer gemeinsamen Vertiefung. Bei einigen Majoidea bilden verschiedene Stacheln und Lappen eine schützende Haube um die Augen, die sich jedoch von der echten Augenhöhle der anderen Krebse unterscheidet.[8]
Jedes der Kopfsegmente trägt ein Paar zu Antennen oder Mundwerkzeugen umgebildete Extremitäten, die im Aufbau, dem Spaltbeinmuster der Krebse entsprechend, zweiästig angelegt sind. Dabei folgen auf die beiden Antennenpaare, die Antennulen und die großen Antennen, mit den Mandibeln, den beiden Maxillenpaaren und den darauf folgenden drei Maxillipedenpaaren (diese sind bereits die Extremitäten der ersten drei Thorax-Somiten) die eigentlichen Mundwerkzeuge der Tiere. Die beiden Antennenpaare fungieren primär als Sinnesorgane und spielen eine wichtige Rolle bei der Chemowahrnehmung und beim Aufspüren von Nahrung und Partnern. An der Basis der Antennen befinden sich spezielle Antennendrüsen, die eine wichtige Rolle bei der Osmoregulation und Ausscheidung spielen. Das erste Antennenpaar ist reduziert zu kleinen Antennulen, die bei einigen Krabbengruppen auch fehlen können. Sie sind meist kurz, gegliedert und können gefaltet oder in eine Grube, die Antenullengrube, eingeklappt sein. Hier befindet sich häufig zudem ein Statocysten-Organ, das zur räumlichen Orientierung dient. Wie die meisten anderen Extremitäten sind die Antennulen meistens beweglich und können unabhängig voneinander als Taster oder zur Wasserventilation agieren. Der Stiel der großen Antennen ist z-förmig gefaltet. Das Epistoma ist mit den vorderen und seitlichen Rändern des Rückenschilds und der Antennenbasis verschmolzen. Die Hauptgeißel (Flagellum) ist kurz, dick und kompakt. Die Sinneshärchen liegen büschelartig auf einer Seite.[5]
Die Mandibeln sind verkalkte Strukturen, die zum Zerquetschen oder Schneiden der Nahrung vor der Mundhöhle eingesetzt werden. Sie überlappen leicht und werden seitlich gespreizt, wenn die Nahrung durch die Maxillen und Maxillipeden in den Mund geschoben wird. Danach öffnen und schließen sie sich, um Nahrungsstücke abzuschneiden und aufzunehmen. Fleischfressende Krabbenarten haben tendenziell scharfe Schneidekanten, während Pflanzenfresser eher breite Mahlstrukturen auf den Mandibeln besitzen. Der Palpus der Mandibel, der an ihrer Coxa ansetzt, ist normalerweise gut entwickelt und hat entweder zwei oder drei Glieder, wobei das letzte Glied in der Regel das größte ist. Die Basis dieses Endgliedes ist bei vielen Krabben mit einer dichten Reihe von Borsten besetzt. Das Exopodit der Mandibelpalpen ist bei allen Zehnfußkrebsen verloren gegangen und fehlt entsprechend auch bei den Krabben.[9]
Die zwei Maxillenpaare bestehen aus abgeflachten, blattartigen Anhängen unterhalb der Mundhöhle. Verschiedene Anhänge oder Enditen entlang ihrer Ränder werden zum Halten und Manipulieren der Nahrung verwendet und führen diese letztlich in den Mund. Die ersten Maxillen (Maxillulae) haben keine Exopoditen und bestehen hauptsächlich aus einer Gruppe von Enditen mit Stacheln. Die zweiten Maxillen besitzen eine seitliche Klappe, den Scaphognathiten, der dazu dient, Wasser durch die Kiemenkammern zu pumpen und so die Atmung zu ermöglichen.[9]

Die drei Maxillipeden-Paare sind umgestaltete Thoraxextremitäten und sitzen entsprechend nicht am Kopf, sondern an den ersten drei Segmenten des Thorax. Sie sind vor dem Mund positioniert und dienen zusammen mit den Maxillen und den Mandibeln der Nahrungsaufnahme. Sie bestehen, im Gegensatz zu den anderen Thoraxextremitäten, den Pereiopoden, aus zwei Beinästen und tragen alle Epipoditen, die hier als Flabella bezeichnet werden und in die Kiemenkammern reichen, wo sie zur Reinigung der Kiemen eingesetzt werden. Ein Exopodit, auch Exognath genannt, ist zusätzlich bei den Maxillipeden der meisten Krabben vorhanden, kann aber bei einigen Süßwasser- und Landarten reduziert sein.[10] Das erste und kleinste Maxilliped arbeitet mit dem zweiten bei der Sortierung der Nahrung und bei der Zuführung der Nahrung in den Mund zusammen. Die Endopoditen sind meistens reduziert, die Epipoditen teilweise sehr langgestreckt. Der zweite Maxilliped hat für die Nahrungsführung spezialisierte und artspezifisch ausgebildete Borsten entwickelt. Bei den Winkerkrabben (Uca) wurden dabei etwa sechs verschiedene Typen von Borsten unterschieden, darunter vor allem löffelartige mit unterschiedlichen Krümmungen.[10] Die dritten Maxillipeden sind die vordersten Strukturen und bilden in der Regel eine mehr oder weniger geschlossene Abdeckung des Mundraums. Bei einigen Krabben sind sie groß, fast folienartig und bedecken den größten Teil der Mundhöhle. Dabei bilden sie eine Kammer, die den anderen Mundwerkzeugen beim Sieben von Sediment hilft. Ein Exopodit des dritten Maxillipeden ist bei den meisten Krabben vorhanden, kann aber bei einigen Süßwasserformen wie den Pseudothelphusidae und den Landkrabben reduziert sein oder sogar fehlen.[10]
Extremitäten von Thorax und Abdomen

Krabben haben wie alle Zehnfußkrebse fünf Beinpaare (Pereiopoden) am Kopf-Brust-Abschnitt (Cephalothorax), die sich aus jeweils sechs, gelenkig verbundenen Gliedern zusammensetzen. Eine Ausnahme machen hier nur die Hexapodidae, bei denen das letzte Beinpaar bei Adulten fehlt.[11] Das erste Paar trägt die Scheren (Chelae), sie werden deshalb als Scherenbeine (Chelipeden) bezeichnet. Die anderen vier sind als Schreitbeine in der Regel einfach gebaut und dienen der Fortbewegung. Bei einzelnen Gruppen, beispielsweise bei den Homoloidea, sind am hinteren Laufbeinpaar weitere scherenartige Greiforgane (Subchela) ausgebildet, die Tragefunktionen vor allem für die Tarnung erfüllen. Bei anderen Gruppen, vor allem den Schwimmkrabben, sind Hand (Prodopus) und Finger (Dactylus) der hinteren Pereiopoden abgeflacht und paddelartig verbreitert und werden zum Schwimmen eingesetzt. Die Scherenbeine und die beiden vorderen Schreitbeinbeinpaare sind bei den Krabben typischerweise anders positioniert als bei anderen Zehnfußkrebsen. Die Chelipeden sind bei den meisten Arten quer über der Vorderseite des Körpers angeordnet, und die Beine sind außer bei einigen basalen Taxa wie den Homolodromiidae seitlich ausgerichtet. Dadurch wurde die Entwicklung einer schnellen seitlichen Fortbewegung mit einer allgemein größeren Bewegungsfreiheit und Habitatwahl ermöglicht.[4]
Die Pleopoden und Uropoden sind bei den Krabben aufgrund der extremen Verkürzung des Hinterleibs entweder nur rudimentär oder vollständig zurückgebildet.[5] Bei Männchen dienen die ersten beiden Pleopodenpaare zur Samenübertragung und werden als Gonopoden bezeichnet. Bei Weibchen wird das zweite bis fünfte Pleopodenpaar zum Tragen der befruchteten Eier eingesetzt.[12] Die Uropoden sind bei einigen Krabben zu Bauchlappen (Homolodromiidae und einige Schwammkrabben) oder Rückenplatten (Dynomenidae und die meisten Schwammkrabben) umgestaltet, den anderen Krabben fehlen sie aber ganz.[4]
_male.jpg)
Innere Organe
Zentralnervensystem
Das Zentralnervensystem der Krabben ist im Vergleich zu anderen Zehnfußkrebsen stark zusammengedrängt. Es besteht aus einer großen, in der Stirnregion oberhalb der Speiseröhre gelegenen Nervenzellansammlung, dem Cerebralganglion („Gehirn“), welches in Protocerebrum (innerviert Augen, Stirnorgane, Sinusdrüse und Kopfmuskeln), Deutocerebrum (für Antennulen) und Tritocerebrum (für Antennen und Vorderdarm, verarbeitet auch Vibrationen von den Schreitbeinen) untergliedert werden kann. Nach hinten folgt das Thoraxganglion, welches aus verschmolzenen Segmentganglien besteht und, im Gegensatz zu anderen Krebstieren und mit Ausnahme der Dromioidea, auch die pleonale Ganglienkette einbezieht. Von hier gegen die Nerven für die Gliedmaßen aus. Zwischen beiden liegt das paraösophageale Ganglion, von dem der Magen-Darm-Nerv ausgeht. Diese drei Hauptganglien sind durch Längsstränge untereinander verbunden. Zudem treten in der Peripherie weitere Nervenknoten auf, beispielsweise am Herz und am Magen.[13]
Verdauungssystem
Das Verdauungssystem ist relativ einfach gebaut. An die kurze Speiseröhre folgt der Darm als größtenteils einfaches Rohr von der Mundöffnung bis zum Anus, der sich bei Krabben am Ende des Telsons befindet. Der Darm kann in drei Abschnitte gegliedert werden: Vorderdarm (Stomodaeum), Mitteldarm und Enddarm (Proctodaeum). Der Vorderdarm beginnt mit einer erweiterten vorderen Kammer (‚Vormagen‘, Proventriculus oder Cardia), welche durch eine Klappe von der hinteren Kammer (Pylorus) getrennt ist. Im Vormagen werden die groben Nahrungsbrocken durch viele (im Grundbauplan 41) Knöchelchen in feine Partikel zermahlen (‚Magenmühle‘). Letztere gelangen in den Pylorusteil, wo die Nahrungspartikel entweder rückenseitig direkt in den Mitteldarm oder bauchseitig in einen Filterbereich (Ampulla) und damit der Verdauungsdrüse (Hepatopankreas) zugeführt werden. Die Verdauungsdrüse an der Grenze von Vorder- und Mitteldarm ist ein zweilappiges Organ und besteht aus vielen Kanälchen. Sie bildet Verdauungsenzyme und dient auch der Speicherung von Lipiden, Glykogen und Mineralstoffen. Der Mitteldarm wird von einem Säulenepithel ausgekleidet, welches einer Basalmembran und einer sehr dünnen Eigenschicht aufsitzt. Durch diese Barriere gelangen die Nährstoffe in die Hämolymphe. Der Mitteldarm dient auch der Osmoregulation. Der Enddarm dient vor allem der Bildung von Kotkügelchen und deren Ausscheidung. Bei pflanzenfressenden Krabben dauert die Nahrungspassage etwa 12 Stunden.[14]
Kreislauf- und Atmungsapparat
Das Herz-Kreislaufsystem besteht aus dem im Cephalothorax gelegenden Herz und den Arterien und Venen. Das Herz liegt im mit Hämolymphe („Blut“) gefüllten Herzbeutel. An den Arterienabgängen liegt jeweils eine Klappe, die den Rückfluss verhindert. Fünf Arterien ziehen nach vorn, eine unpaare Kopfarterie – auch ‚vordere Aorta‘, diese kann bei einigen Krabben noch ein zusätzliches Stirnherz (Cor frontale) enthalten – zu den Augen, ein Paar seitliche Arterien zu den Antennen und Eingeweiden und ein Paar bauchseitige zum Hepatopankreas. Zwei Arterien ziehen nach hinten: die hintere Aorta zu den hinteren Eingeweiden und zum Pleon und die große absteigende Sternalarterie zu den Thoraxanhängen. Die Arterien verzweigen sich zu den Kapillaren. Das Blut sammelt sich anschließend in einem System von Blutleitern (Sinus), welche als infrabranchiale Sinus zur Kiemenbasis ziehen. Sie verzweigen sich in den Kiemenlamellen, wo die Hämolymphe mit Sauerstoff angereichert wird. Die wegführenden Sinusgefäße münden in den Herzbeutel.[15]
Die Kiemenkammern haben bei landlebenden oder semiaquatischen Krabben eine besondere Auskleidung („Lungenkammer“, „Crustaceen-Lunge“) und erhalten Blut aus den verschiedenen Sinus. Das sauerstoffreiche Blut mischt sich im Herzbeutel mit dem Blut aus den Kiemen. Mit speziellen Klappen kann, je nach äußerem Milieu und reguliert über Neurohormone wie Serotonin, der Blutfluss stärker über die Lungenkammer oder die Kiemen erfolgen.[15] Die Kiemen selbst werden von den Anhängen der Thoraxextremitäten gebildet oder sind mit ihnen verbunden. Sie sind als Blattkiemen (Phyllobranchien) ausgebildet, wobei die Podobranchien mit der Coxa, die Arthrobranchien mit der Gelenkmembran zwischen Coxa und Pleuron und die Pleurobranchien mit der Pleurawand des Cephalothorax an der Basis des Anhängsels verbunden sind.[10] Das Wasser wird durch einen Anhang des zweiten Kieferfußes, dem Scaphognathiten, durch die Kiemenkammer geführt.[16]
Ausscheidungssystem
Die Ausscheidung von Ionen und Stickstoff und damit die Osmoregulation findet bei Krabben in den Kiemen und Antennendrüsen statt, zu einem geringen Teil auch im Mitteldarm. Die Kiemen sind also nicht nur Atmungsorgane, sondern sorgen durch die Aufnahme von Ionen aus der Außenwelt und die Ausscheidung von Kochsalz, Calcium und Ammonium-Ionen auch für die Aufrechterhaltung des Ionengleichgewichts und des pH-Werts. Jedes Kiemenblatt ist von einem einschichtigen Epithel bedeckt, welches den mit Hämolymphe gefüllten Innenraum abgrenzt. Das Epithel besteht bei Krabben aus vier Zelltypen. Während die dünnen Zellen vornehmlich dem Gasaustausch dienen, sind die dicken Zellen osmoregulatorisch tätig, die attenuierten Zellen können beide Funktionen wahrnehmen, die Pfeilerzellen sorgen für die mechanistische Festigkeit.[17]

Die Antennendrüse liegt an der Basis oder hinter den Augenstielen. Sie ist mit einer sackartigen Blase verbunden, die sich bis über den Vorderdarm erstreckt. Sie besteht aus einem aus dem Coelom abgeleiteten Sack, den Nephridien, die bei Krabben als verzweigtes Labyrinth und einer erweiterten Blase differenziert sind, sowie einem vom Ektoderm abgeleiteten Harnleiter, welcher die Blase mit der bedeckelten Ausscheidungsöffnung (Nephridiopore) am basalen Antennenglied verbindet. Die Drüse ist für die Ultrafiltration der Hämolymphe über den Coelomsack zuständig, an welche sich eine selektive Absorption und Sekretion innerhalb des Labyrinths anschließt. Das Organ ist sowohl für die Aufrechterhaltung des Ionengleichgewichts als auch für die Stickstoffausscheidung wichtig.[17]
Geschlechtsorgane
Die beiden Hoden liegen rückenseitig im vorderen Cephalothorax. Von hier gelangen die männlichen Samenzellen (Spermatozoen) in einen gewunden verlaufenden Samenleiter (Vas deferens), in dem sie als Spermatophoren gespeichert werden und bei der Begattung über die Geschlechtsöffnung (Gonopore) abgegeben werden. Das Begattungorgan (Penis) wird von einer äußeren Hervorwölbung des Ejakulationsgangs durch die Gonopore gebildet. Es ist gewöhnlich kurz, bei einigen Arten aber sehr lang und in einer Grube im Sternum gelegen. Es dient als Zwischenorgan und transportiert die Spermatophoren zur Basis des ersten Gonopoden (G1).[18]
Die beiden Eierstöcke liegen im Thorax oberhalb des Hepatopankreas, bei den Pinnotheridae können sie sich bis in die Somiten des Pleons erstrecken. Sie sind in der Mitte untereinander verbunden. Die hier produzierten Eier gelangen über den jeweiligen Eileiter (Oviduct) zu den Gonoporen.[18]
Die Position der Geschlechtsöffnung ist bei Krabben ein Klassifikationsmerkmal. Hierbei werden Podotremata mit Gonoporen im Bereich der Hüfte des 3. (Weibchen) oder 5. (Männchen) Laufbeins, Heterotremata mit Gonoporen an der 5. Hüfte bei Männchen und im Bereich des sechsten Thorax-Sternits sowie Thoracotremata, bei denen sie bei beiden Geschlechtern im Bereich des thorakalen Sternums liegen.[5] Bei den Podotremata erhält bei der Begattung die sich bauchseitig öffnende Spermathek die Spermatophoren. Bei den Eubrachyura sind die Eileiter mit der Samentasche (Receptaculum seminis) verbunden, welche über eine Vagina mit der Vulva auf dem sechsten Sternit verbunden ist. Die Vulva ist hierbei so gestaltet, dass sie wie ein Schloss zur Form der Spitze der ersten Gonopode der Männchen passt. Die Begriffe Spermathek und Receptaculum seminis werden manchmal synonym verwendet, die Strukturen sind aber entwicklungsgeschichtlich unterschiedlicher Herkunft.[18]
Krabben zeigen auch äußerlich deutliche Geschlechtsunterschiede (Sexualdimorphismus). Weibchen haben nach der Geschlechtsreife einen breiteren Pleon, Männchen kräftigere Scheren. Zudem unterscheiden sich die Geschlechter in den Pleopoden (s. o.). Hermaphrodismus wie bei anderen Zehnfußkrebsen tritt bei Krabben normalerweise nicht auf.[12]

Verbreitung und Lebensräume
Krabben sind weltweit in aquatischen Lebensräumen verbreitet, wobei sie von den arktischen Regionen um die Pole bis in die Tropen am Äquator anzutreffen sind. Die meisten Krabben besiedeln das Meer (marine Krabben) und kommen dort in fast allen benthischen Lebensräumen von der Tiefsee bis in die Gezeitenzone vor.[5] Im Bereich der Gezeitenzonen in den Tropen sind sie besonders zahlreich, hier können Krabben mit bis zu 50 Tieren pro m2 einen Großteil Biomasse ausmachen.[19] Im Südlichen Ozean treten, bedingt durch die niedrigen Temperaturen und den relativ hohen Magnesium-Gehalt, nur wenige Arten auf und hier vor allem in der Tiefsee. Durch die Erderwärmung dringen Krabben aber mittlerweile auch in den Bereich des antarktischen Kontinentalhangs vor und wurden schon in Tiefen von 720 m gesichtet.[20] Quadratkrabben können gleichzeitig auch im Süßwasser und teilweise an Land (semiterrestrisch) vorkommen. Vier Überfamilien kommen ausschließlich im Süßwasser (limnische Krabben) vor: Gecarcinucoidea, Potamoidea, Pseudothelphusoidea und Trichodactyloidea.[5][21] Heute sind etwa 19 % der Krabbenarten Süßwasserbewohner.[22] Nach aktuellen phylogenetischen Studien fand die Anpassung an nichtmarine Lebensräume innerhalb der Krabben wahrscheinlich mindestens siebenmal und bis zu siebzehnmal unabhängig voneinander konvergent statt und mindestens zweimal gab es auch eine Rückbesiedlung von Meereslebensräumen.[23][24]
Da für den Übergang vom Meer in terrestrische Lebensräume zahlreiche grundlegende Anpassungen nötig wären, lebten die ursprünglichen Formen dieser Linien weitgehend in Gezeitenzonen oder angrenzenden Meeresbereichen, wodurch die ersten Schritte hin zum Leben an Land nur eine relativ geringe evolutionäre Hürde darstellten.[23] Dennoch hat es bei den Krabben, im Gegensatz zu anderen Gliederfüßern, keine nennenswerte Besiedlung terrestrischer Lebensräume gegeben.[22] Es gibt nur relativ wenige reine Landkrabben, die entweder einen marinen (Gecarcinidae) oder einen limnischen Ursprung (Gecarcinucidae und Pseudothelphusidae) haben. Die Abwesenheit von Wasser ist mit Problemen bei der Ausscheidung von Abfallprodukten, der Osmoregulation und der Atmung – Prozesse die über die Kiemen und die Antennendrüse ablaufen (s. o.) – sowie bei Häutung und Larvenverbreitung verbunden. Die Geocarcinidae kehren zur Eiablage in das Meer zurück. Die Süßwasserarten haben dotterreiche Eier und eine stark verkürzte Larvenentwicklung oder eine direkte Entwicklung ohne Larvenstadien. Terrestrische Krabben sind auf tropische und subtropische Regionen begrenzt, in denen es keine gravierenden Temperaturunterschiede gibt. Sie haben zudem Methoden entwickelt, ihren Wasserbedarf aus Kondenswasser und Bodenfeuchtigkeit zu decken. Trockenperioden werden durch Verschluss der Baue und Sommerruhe (Syn. Trockenschlaf oder Ästivation) überstanden. Wenige Arten haben sich an ein Waldleben angepasst. Sie nutzen Baumlöcher in Regenwäldern (z. B. Potamonautes) oder die Flut in Gezeitenwäldern (einige Sesarmidae) zur Deckung ihres Wasserbedarfs.[25]
Lebensweise
Ernährung

Die Ernährungsweisen der Krabben sind vielfältig und die meisten Krabben sind opportunistische Allesfresser (Omnivoren). Die große Mehrzahl der meeresbewohnenden Krabben sind Allesfresser,[26] dabei ist pflanzliches Material häufig vorherrschend. Die Tiere haben zwar eine Tendenz zu pflanzlicher oder tierischer Nahrung, verschmähen aber auch jeweils die andere Nahrungskategorie nicht. Selbst Pflanzenfresser können zu Fleischfressern oder gar Kannibalen werden und Artgenossen verspeisen,[27] die sie insbesondere während oder kurz nach der Häutung attackieren, wenn der Panzer noch weich ist.[28] Die Ernährungsweise kann zudem je nach geografischem Gebiet, Jahreszeit oder sogar Tageszeit wechseln. Zudem ändern sich die Ernährungsweisen im Zuge der Individualentwicklung von den Larvenstadien zu den ausgewachsenen Tieren. Die freischwimmende Zoea-Larven ernähren sich dabei vor allem von Phyto- und Zooplankton und passen sich im Zuge der Entwicklung an die artspezifischen Ernährungsgewohnheiten an.
Sedimentfresser ernähren sich von organischen Ablagerungen (Sedimenten) des Gewässerbodens, die aus Pflanzenresten, der Mikrovegetation (Microphytobenthos) und oft auch aus kleinen tierischen Lebewesen (Meiofauna) bestehen. Diese Ernährungsweise ist vor allem bei den Ocypodoidea anzutreffen. Sie wird durch einen Filterapparat aus modifizierten Mundwerkzeugen ermöglicht, der Schwebstoffe abtrennt.[29]
Pflanzenfresser (Herbivoren) ernähren sich von lebenden Pflanzen und Makroalgen, unter anderem durch das Abkratzen von Krustenalgen und das Ernten von fadenförmigen Algen als Substratbewuchs. Da Algen eine geringere mechanische Festigkeit als Pflanzen haben, ist der Aufwand zur Zerkleinerung und Verdauung geringer und reine Algenfresser haben weichere Mundwerkzeuge, teilweise mit löffelartigen Spitzen. Pflanzenfresser wie die meisten Landkrabben, die sich von Blättern, Streu und Gefäßpflanzenmaterial ernähren, sind dagegen mit kräftigeren und muskulöseren Scheren ausgestattet.[30] Sie können erhebliche Schäden am Uferbewuchs verursachen, während Algenfresser in Korallenriffen eher einen positiven Effekt auf das Ökosystem haben, weil sie eine Überwucherung mit Algen verhindern.[31]
Fleischfresser (Carnivoren) ernähren sich von anderen Tieren und bejagen aktiv eine Vielzahl von aquatischen und terrestrischen Wirbellosen und sogar Fische, das schließt häufig auch den Kannibalismus an Artgenossen ein. Beispiele für Beutetiere sind Schnecken, Muscheln, Napfschnecken und Seepocken sowie andere Krebstiere. Große Landkrabben wie Rodriguezus garmani jagen sogar Schlangen.[26] Zudem gibt es zahlreiche Arten, die bei Gelegenheit Aasfresser sind.[31]
Detritrusfresser (Detritivoren) wie die Grapsoidea ernähren sich von abgestorbenen Pflanzenresten (Detritus), die relativ nährstoffarm sind und wenig Stickstoff enthalten. Detritrusfresser spielen eine wichtige Rolle beim Abbau organischer Substanz im Ökosystem und reduzieren vor allem in Mangrovenwäldern das Ausschwemmen von Nährstoffen mit den Gezeiten.[31]
Die Vielfalt der Ernährungsweisen hat einen großen Einfluss auf die Morphologie, insbesondere auf die Ausgestaltung der Mundwerkzeuge und des Verdauungssystems. So ist die Struktur des Kaumagens an die jeweilige Diät angepasst. Krabben, die zähes Pflanzenmaterial fressen, haben zudem oft große, schwere Scheren mit spitzen „Fingern“ und einer für das Zerreißen und Zerschneiden von Blättern und Pflanzen optimierten Bezahnung. Die Art der Nahrung ist mit Anpassung der Scheren verbunden. Krabben, die sich von hartschaliger Beute wie Muscheln oder Austern ernähren, haben kräftige, aber langsam schließende Scheren. Dagegen sind die Scheren bei Arten, die bewegliche Beute wie Vielborster oder Fische jagen, schlanker und länger. Löffelartige Finger scheinen dagegen für die Aufnahme von Detritus, Schleim, weichen Nahrungsbestandteilen oder das Abkratzen von Algen genutzt zu werden.[32]

Fortpflanzung
Bei den Podotremata ist die Spermathek der Weibchen eine Einsenkung des Sternums ohne direkte Verbindung zu den inneren Geschlechtsorganen, bei diesen ‚primitiven‘ Krabben findet eine äußere Befruchtung wie bei anderen Krebstieren statt. Bei den übrigen Krabben ist die Spermathek eine Erweiterung des Oviducts und es findet eine innere Befruchtung statt. Wenn Männchen geschlechtsreif werden, sammeln sich in ihren Samenleitern Spermatophoren an. Bei Weibchen gibt es keine eindeutigen Kriterien, denn die Eierstöcke sind zum Zeitpunkt der Begattung häufig noch unreif und die Ovulation kann beträchtliche Zeit nach der Begattung erfolgen. Hier ist die Pubertäts-Häutung ein ziemlich verlässlicher Indikator für die Geschlechtsreife. Männchen kopulieren erst, wenn der Panzer nach der Häutung ausgehärtet ist, bei Weibchen findet die Kopulation meist in der Phase statt, in der der Panzer noch weich ist, vor allem bei jenen Arten mit einer bedeckelten Vulva. Es gibt zwei Grundmuster in der Partnerwerbung. Bei den Arten mit Kopulation unmittelbar nach der Häutung trägt das Männchen das Weibchen bis zum Einsetzen der Häutung über mehrere Tage und häufig auch nach der Begattung bis das Weibchen ausgehärtet ist. Das zweite Grundmuster tritt bei Arten auf, bei denen der Paarung unmittelbar keine Häutung vorangeht. Hier dauert die Partnerwerbung meist nur Minuten und dient der Erkennung der Paarungsbereitschaft. Hierbei spielen chemische, taktile, visuelle und auditive Reize eine Rolle. Eine Ausnahme von diesen Grundmustern macht nur die Maskenkrabbe, hier werden auch die voll ausgehärteten Weibchen über mehrere Tage von den Männchen getragen, wobei in dieser Zeit der Vulvadeckel (Operculum) aufweicht.[33]

Die Samenleiter der Männchen münden auf kurzen muskulösen Vorsprüngen, welche als Penis angesehen werden können. Damit die Spermienhaufen von hier zu den Weibchen gelangen können, sind das erste und zweite Pleopoden-Paar zu zusätzlichen Begattungsorganen umgewandelt. Das erste Pleopodium ist eine Röhre mit einer Öffnung an der Spitze und zwei an der Basis. In das eine Basisloch wird der Penis, in das andere das zweite, stangenförmige Pleopodium eingeführt. Bei der Begattung stehen sich beide Partner Kopf an Kopf gegenüber, wobei ihre Sternum-Oberflächen eng aneinander liegen. Dann wird das Ende des ersten Pleopodiums in die Vulva des Weibchens eingeführt. Das Sperma wird durch Muskelarbeit über den Penis in das erste Pleopodium gepumpt und durch kolbenartige Stöße des zweiten Pleopodiums in die Spermathek des Weibchens, wo es bis zum Eisprung gespeichert wird. Die Dauer dieses Vorgangs kann je nach Art stark variieren, von fünf Minuten bis zu fünf Stunden. Bei manchen Arten bildet sich in der Spermathek ein harter Klumpen aus Spermien und Samenleiterflüssigkeit (‚sperm plug‘), dessen Bedeutung nicht geklärt ist.[34] In der Spermathek können die Spermien zwischen drei Monaten und zwei Jahren fruchtbar bleiben, bei einigen Arten bis zu vier Jahre.[35]
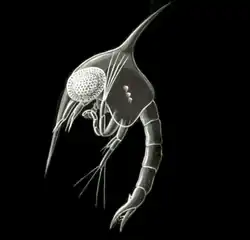

Wie alle Vertreter der Unterordnung Pleocyemata tragen die Krabbenweibchen die Pakete mit den, die Embryonen enthaltenen Eiern mit ihren Pleopoden bis zum Schlupf der Larven mit sich, Männchen beteiligen sich nicht am Schutz der Nachkommen. Die Weibchen halten die Brut mit ihren Scheren und Schreitbeinen frei von Zersetzungsprodukten und schädlichen Epibionten und fächern ihr durch Flattern mit dem Pleon sauerstoffreiches Wasser zu. Bei einige Krabbengruppen bildet das Pleon Brutkammern, bei einigen wird die Brut über inneren Kontakt mit der Kiemenkammern belüftet. Die Vertreter der Gattung Neorhynchoplax sind die einzigen viviparen Krabben. Eine Brutpflege der geschlüpften Jungtiere ist bei Meereskrabben sehr selten, bei Land- und Süßwasserkrabben dagegen häufig. Die Nachwuchsverluste sind bei den Krabben sehr unterschiedlich. Sie schwanken bei Krabben ohne mütterliche Fürsorge je nach Art und Lebensraum zwischen 3,5 und 83 %, mit dieser zwischen 5 und 50 %.[12]
Die Larven können sich morphologisch so stark von den Adulten unterscheiden, dass viele von ihnen im 18. Jahrhundert als eigene Arten angesehen wurden. Dieses Problem wurde erst in jüngerer Zeit überwunden, als man die gesamte Entwicklung unter Laborbedinungen beobachten konnte. Man unterscheidet in der Entwicklung der Krabben drei Entwicklungsphasen: Zoea, Megalopa (Decapodide) und Postlarve, zwischen denen jeweils eine Gestaltwandlung (Metamorphose) stattfindet. Das erste Larvenstadium der Zehnfußkrebse (Nauplius, „Eilarve“) wird bei Krabben vermutlich noch beim Embryo durchlaufen.[36] Nur einige wenige Arten von Meereskrabben in Australasien haben eine direkte Entwicklung, hier werden die Larvenstadien übersprungen und Weibchen tragen die Eier solange bis aus ihnen das Jugendstadium schüpft (direkte Entwicklung).[37]
Die Zoea-Larve ist die Planktonphase der Krabbenentwicklung. Bei ihr sitzen auf mehreren oder allen Endgliedern der Thoraxanhänge Schwimmfüße, während die Pleopoden rudimentär sind oder fehlen. Eine zweigliedrige dritte Maxillipede und zweilappige Schere und Pereiopoden entstehen, die aber funktionslos sind. Zudem haben Zoea-Larven ein Paar Komplexaugen.[36] In der Zoea-Phase durchlaufen die Krabben zwei bis acht Stadien, bei denen es zu keinem grundlegenden Gestaltwandel (Metamorphose), sondern nur zu einer Zunahme der Zahl und Komplexität der Anhänge für das Schwimmen und die Nahrungsaufnahme kommt.[38]
Gewöhnlich folgt auf die Zoea ein einzelnes Decapodid-Stadium, welches bei Krabben als Megalopa bezeichnet wird. Es sieht bereits krabbenähnlicher aus und stellt den Übergang zur benthischen Lebensweise dar.[39] Die Megalopa ist durch die vollständige Entwicklung aller Metameren sowie voll funktionstüchtige Pereio- und Pleopoden charakterisiert. In der Häutung zur Megalopa ändert sich die funktionelle Gestalt der Maxillipeden I und II von Anhängen zum Schwimmen zu Strukturen zur Nahrungsaufnahme.[38] Das Pleon hat bei der Megalopa noch die Form der Decapodenvorläufer, ist noch nicht abgeflacht[36] und noch nicht nach vorn umgeschlagen.ref name="Braig" /> Das Megalopa-Stadium fehlt bei den Hymenosomatidae und bei einigen Sesarmidae mit stark verkürzter Entwicklung.[38]
Als Postlarvenphase (der Begriff ‚Postlarve‘ wird in der Literatur nicht einheitlich verwendet) werden alle weiteren Entwicklungsphasen, also die Jugendformen (Juvenile) und erwachsenen (Adulte) Krabben zusammengefasst. In der letzten Häutung von der Megalopa zur Postlarve werden die Merkmale der Adulten mit Ausbildung der Schreitbeine und Umwandlung der ersten beiden Pleopoden zu Kopulationsorganen bei den Männchen bzw. zu eitragenden (Pleonsegmente 2–4) Extremitäten bei Weibchen.[36] Anschließend vollziehen junge Krabben mit benthischer Lebensweise eine deutliche Größenzunahme mit zahlreichen weiteren Häutungen ohne markante Gestaltveränderungen, die letztlich zu den geschlechtsreifen Adulten führen.[38]
Ab dem Jugendstadium wird die verfügbare Energie zwischen Wachstum und Fortpflanzung verteilt. Zunächst wird bis zum Erreichen der Geschlechtsreife die gesamte überschüssige Energie für das Wachstum verwendet. Mit Erreichen der Geschlechtsreife gibt es bei Krabben zwei Entwicklungsstrategien. Bei einer Gruppe wird nach der letzten Häutung die gesamte Energie zur Reproduktion verwendet. Die Mehrzahl der Krabben wächst jedoch zeitlebens, hier wird die verfügbare Energie sowohl zum Wachstum als auch zur Häutung verwendet.[37] Wie bei allen Gliederfüßern ist das Wachstum diskontinuierlich, zur Größenzunahme muss die äußere Kutikula abgeworfen und neugebildet werden (Häutung). Dabei wird zunächst die innerste Schicht der Kutikula abgebaut, wodurch sich Kutikula und die Hypodermis voneinander lösen. Durch Kanäle werden organische Substanz und Calciumcarbonat zurückgewonnen und die Hypodermis sondert die neue äußere Kutikulaschicht (Epicuticula) ab. Diese ist zunächst weich. Durch Anstieg des hydrostatischen Drucks im Cephalothorax bricht er, meist entlang von Häutungslinien, auf und die Körperanhänge werden vorsichtig aus der alten Hülle zurückgezogen. Dann wird das gesamte Exoskelett, einschließlich der Auskleidung von Speiseröhre und Hinterdarm abgestoßen. Anschließend nimmt die Krabbe bis zur vollständigen Entfaltung viel Wasser sowie Calcium auf. Der Häutungsvorgang wird durch Hormone gesteuert.[40]
Ökologie
Fressfeinde

Krabben sind die Nahrungsgrundlage zahlreicher fleischfressender Tiere. Im Wasser sind sie Beute von Grundfischen, Kopffüßern, anderen Krabben, Fangschreckenkrebsen, Reptilien wie Seeschlangen und Krokodilen sowie Säugetieren. Im Flachwasser, in der Gezeitenzone und an Land werden Krabben vor allem von Vögeln, Reptilien und Säugetieren gejagt. Eine besonders ausgefeilte Jagdmethode hat die Falsche Schwimmratte, eine seltene Art der australischen Tropen. Sie beißt der Krabbe zunächst die Augen ab, dann ihre Scheren und macht sich erst dann an den Verzehr der Weichteile. Die Gefahr von Beutegreifern gefressen zu werden, ist vor allem von der Größe der Krabbe abhängig. Sehr große und stark gepanzerte Krabben werden nur selten erbeutet.[41]
Krabben als Symbionten
_Figure_1.jpg)
Einige Krabben sind Mitbewohner (Symbionten) bei anderen Lebewesen, sie kommen also zusammen mit diesen vor. Ob sie dabei Parasiten, Mutualisten oder Kommensalen sind, ist nicht in jedem Fall geklärt. In der aktuellen Literatur wird daher nur noch der Begriff Symbiont verwendet, egal ob das Zusammenleben den anderen Partner schädigt, nicht beeinträchtigt oder ihm sogar nützt. Die Symbiose kann obligat sein, die Krabbe ist also zwingend an die andere Art gebunden, oder fakultativ.[42]
Nahezu alle Arten der Krabbenfamilien Aphanodactylidae, Cryptochiridae, Domeciidae, Pinnotheridae, Tetraliidae und Trapeziidae sind obligate Symbionten, auch in vier weiteren Familien (Epialtidae, Pilumnidae, Varunidae und Schwimmkrabben) sind Symbionten häufig. Obligate Symbionten sind hochspezialisiert und ihre Morphologie ist an das Zusammenleben angepasst.[42] Die Weibchen der Gallkrabben[43], die Domeciidae[44] und die Tetraliidae[45] sind obligate Symbionten bei Steinkorallen, die Trapeziidae auch bei anderen koloniebildenden Nesseltieren und bei Schwämmen.[46] Die Pilumnidae sind an Stachelhäuter,[47] die Aphanodactylidae und Pinnotheridae an Muscheln, Stachelhäuter und Seescheiden gebunden und nutzen die Höhlen und Gänge von Vielborstern wie Schopfwürmern sowie von anderen Zehnfußkrebsen und Wirbellosen.[48]
Fakultative Symbionten kommen vor allem innerhalb der Inachidae, Dreiecks- und Rundkrabben vor. Sie haben nicht diese starke morphologische Anpassung und können auch auf anderen Substraten leben.[42]
Symbionten und Krankheitserreger bei Krabben
Viren

Etwa 30 Viren sind als Krankheitserreger bei Krabben beschrieben, einige davon führen aber nur zu Schädigungen befallener Zellen und verursachen keine Allgemeinerkrankungen. Problematisch sind Viruserkrankungen vor allem in Krabben-Aquakulturen. Durch die hohe Besatzdichte und dem damit verbundenen Stress sowie Hitzestress können Viruserkrankungen zu erheblichen Verlusten führen. Zudem kann es zur massiven Freisetzung von Viren in die natürlichen Lebensräume und damit zur Gefährdung wildlebender Krabben kommen. Es besteht noch erheblicher Forschungsbedarf, um Wirtsspektrum, geografisches Verbreitungsgebiet, Verbreitung in natürlichen Populationen, Pathogenität, Übertragungswege und die Rolle der Viren bei Sekundärinfektionen aufzuklären.[49]
Es gibt acht verschiedene Reoviren bei Krabben. Auch das erste, überhaupt bei Krabben nachgewiesene Virus (P Virus) war ein Reovirus. Die Reoviren W2 und RC84 treten bei Carcinus-Arten auf, das RLV-Virus (Syn. CsRV-Virus) befällt das Nervensystem bei der Blaukrabbe, ruft zentralnervöse Störungen hervor und kann auch zum Tod führen. Die Reoviren EsRV905 und EsRV816 befallen die Chinesische Wollhandkrabbe und spielen vor allem in den ostasiatischen Aquakulturen eine große Rolle. Ersteres verursacht eine als Tremor disease (Syn. trembling disease) bezeichnete zentralnervöse Erkrankung, letztere Todesfälle, allerdings nur bei Wassertemperaturen über 20° C. Das Mud crab reovirus (MCRV) befällt die Geriffelte Mangrovenkrabbe (Scylla serrata) in Aquakulturen und verursacht die sleeping disease. Befallene Tiere werden apathisch, zeigen eine Atrophie des Hepatopankreas und eine Grauverfärbung, bei höheren Wassertemperaturen treten Todesfälle auf. Zwei Arten von Dicistroviridae befallen Krabben. Das Taura Syndrome Virus ruft das Taurasyndrom hervor und verursacht schwere Verluste, vor allem in amerikanischen Garnelen-Aquakulturen. Das Mud Crab DicistroVirus-1 (MCDV-1) infiziert Scylla paramamosain in China und kann eine Mortalität von bis zu 100 % verursachen. Das Crab Haemocytopenic Virus (CHV, Familie Bunyaviridae) ruft bei Krabben Erkrankungen der Hämolymphe mit Verklumpung der Blutzellen und Blutgerinnungsstörungen hervor. In natürlichen Lebensräumen ist das Virus nur gering verbreitet. Das S virus ist bislang nicht klassifiziert und verursacht Infektionen bei Ruderkrabben im Mittelmeer mit Mortalitätsraten von 70 bis 80 %. Das Cancer pagurus bacilliform virus (CpBV) und das White Spot Virus (WSV) befallen Taschenkrebse und können eine Mortalität von bis zu 66 % verursachen. Diese Viren spielen vor allem in europäischen Tankhaltungen eine Rolle.[49]
Vier verschiedene Picornaviren kommen bei Krabben vor. Das bedeutendste ist das Chesapeake Bay virus (CBV). Es verursacht schleichende Erkrankungen bei der Blaukrabbe, vor allem der Ommatiden mit Blindheit und führt nach ein bis zwei Monaten zum Tod. Von den beiden bei Krebsen auftretenden Roniviren kommt bei Krabben nur das Eriocheir sinensis ronivirus vor und gilt als Verursacher des Black gill syndrome mit Nekrosen der Kiemen. Vier Rhabdoviren treten bei Krabben auf, ihre Pathogenität ist aber nicht geklärt. Die acht bei Krebsen vorkommenden Baculoviren werden nur sporadisch bei Krabben gefunden, sie sind vermutlich vor allem ein Erregerreservoir für andere Krebstiere. Das White Spot Syndrome Virus (WSSV) aus der Familie der Whispoviridae spielt vor allem in Garnelenzuchten eine Rolle, hat aber ein breites Wirtsspektrum und befällt auch 14 Krabbenarten, sowohl im Freiwasser auch als in Kulturen. Es kommen sowohl akute und subakute Verläufe mit hoher Mortalität vor als auch solche mit geringen oder gar keinen Krankheitserscheinungen. Von den beiden Krabben-Herpesviren spielt das Bi-facies virus (BFV) bei der Blaukrabbe eine Rolle, welches Todesfälle ohne deutliche vorherige Krankheitserscheinungen im Bereich der US-amerikanischen Ostküste verursacht.[49]
Bakterien
Obwohl bakterielle Infektionen häufig sind, ist die Anzahl nachgewiesener Erreger überschaubar. Solche Infektionen spielen nicht nur in der Krabbenzucht eine Rolle. Da einige, wie beispielsweise Vibrio vulnificus, Listeria monocytogenes, Salmonella enterica, Vibrio cholerae oder Clostridium botulinum Zoonoseerreger sind, können sie beim Verzehr von Krabbenfleisch auch auf den Menschen übergehen. Andersherum können auch durch menschliche Fäkalien in das Wasser gelangte Erreger wie Salmonellen eine Infektionsquelle für Krabben darstellen, was für die Karibik nachgewiesen wurde. In Louisiana sind in Krabben gegen Streptomycin resistente Plesiomonas shigelloides aufgetaucht, die offensichtlich über menschliche Abwässer in das Meer gelangt sind. Ein weiteres Problem ist, dass bestimmte Bakterien wie Vibrionen auch in der Hämolymphe gesunder Krabben vorkommen und erst Stress zur Erkrankung führt (Faktorenkrankheit). Krabben haben eine mannigfaltige Bakterienflora, allein bei der Blaukrabbe sind fast 50 Arten, davon 41 in der Hämolymphe, nachgewiesen, nur knapp ein Viertel der Tiere hat eine sterile, also bakterienfreie Hämolymphe. Einige Darmbakterien der Krabbe lösen in Kulturen nur bei Krabbenlarven Erkrankungen aus.[50]
Von den Mollicutes hat vor allem Spiroplasma eriocheiris als Auslöser der Tremor disease bei der Chinesischen Wollhandkrabbe erhebliche wirtschaftliche Bedeutung in den ostasiatischen Krabbenkulturen. Chlamydien können beim Kalifornischen Taschenkrebs zu Organnekrosen und schweren Allgemeinstörungen führen. Sie wurden vor allem Mitte der 1980er Jahre in den Wintermonaten entlang der Küste Washingtons beobachtet. Vibrionen sind bei Krabben weit verbreitet, einige wie Vibrio alginolyticus, Vibrio harveyi, Vibrio metschnikovii oder Vibrio parahaemolyticus können bei Überbesatz und schlechter Wasserqualität in Aquakulturen auch Krankheitserscheinungen hervorrufen. An der Shell disease („Schalenkrankheit“) sind verschiedene Bakterien beteiligt, vermutlich ermöglichen die Enzyme chitinoklastischer (chitinauflösender) Bakterien deren Eindringen. Sie zeigt sich in zunächst punktförmigen Läsionen des Außenskeletts, die sich zu größeren Defekten vereinen und zu Störungen der Häutung, Sepsis oder auch zum Abbrechen der Beine führen. Sie wird ebenfalls als Faktorenkrankheit angesehen.[50]
Pilze und Protisten
Eipilze leben primär von abgestorbenem organischen Material, sind also Saprobionten. Vertreter der Gattungen Lagenidium (insbesondere Lagenidium callinectes), Haliphthoros und Atkinsiella sowie Pythium thalassium und Leptolegnia marina können aber auch Krabben-Embryonen befallen und zum Absterben aller Embryonen und Larven führen, sowohl unter natürlichen Bedingungen als auch in Aquakulturen. Die ebenfalls zu den Stramenopilen gehörenden, saprophytischen Thraustochytrida können Eipakete der Krabben zerstören. Die zu den Jochpilzen gehörenden Eccrinales kommen als Kommensalen im Darm von Krabben vor, können aber auch parasitische Eigenschaften haben.[51]
Nur wenige Echte Pilze und Hefen der Gattung Ophiocordyceps sind als Krankheitserreger bei Krabben bekannt. Trichomaris invadens wächst im Exoskelett und verursacht vor der Küste Alaskas das Black mat syndrome bei Schnee- und Tanner-Krabben mit dunklen Belägen auf dem Panzer.[52] Exophiala cancerae ist ebenfalls ein freilebender Saprophyt, kann aber auch die inneren Organe von Krabben befallen. Dann löst er die Lethargic crab disease aus, eine Krankheit mit Abgeschlagenheit, Krämpfen und Ataxien, die auch tödlich enden kann. Zwölf Arten aus acht Gattungen der Microsporidien sind bei Krabben als Krankheitserreger bekannt. Sie befallen vor allem die Skelettmuskelzellen, einige auch die Herzmuskelzellen, das Hepatopankreas, Epithelzellen und den Eierstock.[51]
Protozoen

Paramarteilia canceri (Ordnung Paramyxida) verursacht systemische Erkrankungen beim Taschenkrebs. Haplosporidien treten vor allem bei Weichtieren auf, Paramikrocytos canceri wird im Ärmelkanal aber auch beim Taschenkrebs beobachtet und schädigt hier die Epithelien der Antennendrüsen. Die Haplosporidie Urosporidium crescens ist ein Hyperparasit, der Metazerkarien von in Krabben vorkommenden Saugwürmern befällt und durch Ansammlung dunkler Sporen zur deutlichen Vergrößerung dieser Saugwurmlarven führt. Dadurch entstehen schwarze Punkte in Muskulatur, Kiemem und inneren Organen, was zum Bild der „Pfeffer-Krabben“ (engl. pepper crabs, pepper spots) führt. Haplosporidium louisiana tritt an der US-amerikanischen Ostküste bei Krabben der Überfamilie Xanthoidea auf. Durch Ansammlung der Sporen kann es zur Schwarzverfärbung kommen. Haplosporidium cadomensis und Haplosporidium littoralis befallen Krabben an den europäischen Küsten.[53]
Wimpertierchen sind größtenteils Symbionten oder Kommensalen auf den äußeren Oberflächen von Krabben. Peritriche Wimperntierchen können bei hohem Befall ihren Wirt schädigen und Krankheiten auslösen, weil sie auf den Kiemen die Atmung beeinträchtigen. Auch die meisten apostomen Wimperntierchen sind Symbionten, eine Ausnahme ist Synophrya hypertrophica. Dieser Parasit befällt eine Vielzahl von Krabbenarten und auch andere Krebstiere und pflanzt sich bei der Häutung in die Kiemen ein und ernährt sich von Hämolymphe. Der Körper reagiert auf den Eindringling mit der Bildung von Melanin, wodurch schwarze Flecken entstehen (Black spot disease). Scuticociliatia kommen sowohl freilebend als auch parasitisch vor. Vier Arten (Mesanophrys maggii, Mesanophrys carcini, Mesanophrys pugettensis und Mesanophrys chesapeakensis) treten bei Krabben auf, unter natürlichen Bedingungen sehr selten, in Krabbenzuchten gab es aber wiederholt schwere Ausbrüche. Gibt es eine Eintrittspforte, besiedeln sie innere Organe und führen binnen einer Woche zum Tod.[53] Wimperntierchen der Gattung Synophrya siedeln sich auf den Kiemen an und verursachen dort Läsionen.[54]
Von den 140 parasitischen Dinoflagellaten kommen nur Hematodinium-Infektionen bei Krabben vor. Ihr Übertragungsweg ist unbekannt, sie können aber schwere ökonomische Verluste in der Krabbenfischerei verursachen, weil sie das Fleisch zahlreicher Krabbenarten ungenießbar machen.[55] Von den Apicomplexa treten 43 Arten von Gregarinen und vier Kokzidienarten bei Krabben auf.[53]
Plattwürmer
Die meisten Strudelwürmer sind freilebend, sie können aber als Kommensalen bei Krabben vorkommen. Fecampia erythrocephala entwickelt sich dagegen im Hämocoel und kann eine solche Größe erreichen, dass es zum Absterben des Wirts kommt, die Art wird als Parasitoid angesehen.[56]
Saugwürmer sind dagegen relativ häufig bei Krabben. Für einige Digenea sind Krabben Zwischenwirt und der Endwirt, meistens ein Wirbeltier, steckt sich mit den Metazerkarien durch das Verspeisen der Krabbe an. Für den Menschen ist vor allem der Lungenegel Paragonimus westermani in Asien von Bedeutung. Auch für eine Reihe von Arten der Überfamilie Microphalloidea sind Krabben Zwischenwirt. Sie verursachen eine umschriebene Nekrose, bei Befall des Nervengewebes der Krabbe auch Bewegungsstörungen und können auch eine erhöhte Sterblichkeit bei Krabben verursachen.[56]
_Figure_1.jpg)
Auch für einige Bandwürmer sind Krabben lediglich Zwischenwirt, in ihnen entwickelt sich die Metazestode. Etliche Vertreter der Bandwurmordnungen Tetraphyllidea, Trypanorhyncha und Lecanicephalidea (Endwirt sind Plattenkiemer) können in Krabben hohe Befallszahlen zeigen und bei ihnen Verdauungsstörungen verursachen.[56]
Schnur-, Saiten-, Kratz-, Faden- und Ringelwürmer
Schnurwürmer der Gattungen Carcinonemertes und Ovicides sind obligate Ei-Räuber bei Krabben und einigen anderen Zehnfußkrebsen. Sie legen ihre Eier in das Eipaket des Krabbenweibchens und können hohe Bestandsverluste verursachen.[57]
Bei Saitenwürmern sind nur die Larven Parasiten von Gliederfüßern. Mindestens zwei Arten, Nectonema agile und Nectonema zealandica, nutzen Krabben als Wirt. Sie führen während ihrer Entwicklung zu ausgeprägten Schädigungen im Wirt und bereits eine Larve kann den Tod der Krabbe verursachen.[58]
Für einige Kratzwürmer (Gattungen Profilicollis, Hexaglandula und Arhythmorhynchus) sind Krabben erster Zwischenwirt oder Stapelwirt. Sie können bei Krabben zu Veränderungen der Pigmentierung, zu Unfruchtbarkeit und zu Veränderungen des Verhaltens führen, wodurch sie leichtere Beute für den Endwirt (krabbenfressende Vögel und Meeressäugetiere) werden.[59]
Für einige Spulwürmer der Gattungen Anisakis und Hysterothylacium sind Krabben Zwischen- oder Stapelwirt. Auch für andere Rollschwänze können Krabben als Zwischen- oder Stapelwirt fungieren, für einige wenige auch als Endwirt, beispielsweise für die im Hepatopankreas parasitierende Art Heptochona praecox. Rhabditida der Gattung Crustorhabditis leben als Symbionten auf den Mundwerkzeugen von Krabben, einige Monhysterida als Symbionten auf den Kiemen.[60]
Ringelwürmer spielen als Symbionten, Parasiten oder auch als Beutetiere (vor allem Vielborster) eine Rolle. Krebsegel sind obligate Ektosymbionten, leben also auf den Oberflächen von Krebstieren, und kommen im Süßwasser oder Wasser mit geringem Salzgehalt vor. Viele Egel sind Fischparasiten und nutzen Krabben nur zur Eiablage ohne sie zu schädigen, einige wenige wie Myzobdella platensis saugen Hämolymphe bei Krabben. Vielborster der Familie Iphitimidae leben als Symbionten auf den Kiemen von Krabben.[61]
Gliederfüßer

Ruderfußkrebse der Familie Nicothoidae sind Parasiten bei einer Vielzahl von Krebstieren, aber nur gelegentlich bei Krabben. Sie fressen die Eier oder saugen Hämolymphe. Harpacticoida sind dagegen Symbionten. Die zu den Rankenfußkrebsen gehörenden Wurzelkrebse können durch Beeinflussung des Hormonssystems bei Krabben zu Feminisierung der Männchen und Verlust der Fortpflanzungsfähigkeit (Kastration) führen. Weibliche Cyprislarven der Wurzelfußkrebse entwickeln ein verzweigtes Nährstoff-absorbierendes System (Interna) und bilden schließlich einen Fortpflanzungskörper (Externa), welcher bei der Häutung der Krabbe freigesetzt wird. Etwa 190 Arten von Wurzelkrebsen parasitieren bei Krabben und können erhebliche Schädigungen des Wirts hervorrufen. Rankenfußkrebse der Teilklasse Thoracica sind größtenteils Kommensalen, bei starkem Befall können sie aber auch zu Schädigungen der Krabbe führen. Nur sehr wenige Flohkrebse kommen bei Krabben vor, meist auch nur als Ektosymbionten, lediglich Ischyrocerus commensalis spielt auch als Eiräuber eine Rolle.[62]
Asseln der Unterordnung Epicaridea sind obligate Parasiten bei Krabben. Sie nutzen Ruderfußkrebse als Zwischenwirt, ihr drittes Larvenstadium (Cryptoniscus) verlässt diesen, befällt den Endwirt und entwickelt sich dort zum Jugendstadium (Bopyridium), meist in der Kiemenkammer der Krabbe. Letztere schwillt dadurch oft stark an, so dass der Befall schon äußerlich leicht zu erkennen ist. 28 Arten der Familie Entoniscidae sind Endoparasiten bei Krabben, in denen sich die Weibchen zu tumorähnlichen Gebilden entwickeln.[62] Von den Cryptoniscoidea sind bislang 11 Arten, darunter Danalia hapalocarcini, als Ektoparasiten bei Krabben bekannt.[63] Über 300 Arten der Bopyridae parasitieren bei Krabben, vor allem bei gleichzeitigem Befall mit anderen Parasiten kann der Nährstoffverlust auch zum Verlust der Fortpflanzungsfähigkeit der Krabbe führen.[62]
Einige Meeres- und Hornmilben kommen bei Krabben vor, ihre Bedeutung ist aber weitgehend ungeklärt. Zweiflügler haben vielfältige Beziehungen zu Krabben der Uferzonen und zu Landkrabben. Sie nutzen ihre Baue, Kriebelmücken-Larven deren Panzer als Anheftungsstelle und sind wohl eher als Symbionten zu betrachten.[62]
Krabben als Neozoen

Zahlreiche Krabbenarten wurden durch den Menschen aktiv oder passiv von ihren angestammten Lebensräumen in neue neue Gebiete verbracht und konnten sich dort als Neozoen bzw. invasive Arten etablieren und ausbreiten. Die meisten Länder mit einer Meeresküste betrachten diese invasiven, nicht einheimischen oder gebietsfremden Arten als Bedrohung für die Integrität der einheimischen Ökosysteme. Insgesamt sind mehr als 70 Arten der Krabben und krabbenartigen Einsiedlerkrebse als eingeführte Arten dokumentiert, von denen sich mehr als 50 Arten als invasive Arten etabliert haben. Bei den Arten handelt es sich vor allem um Schwimmkrabben (Portunoidea), Strandkrabben (Grapsoidea) oder Spinnenkrabben (Majoidea).[64][65] Die meisten eingeführten Krabbenarten sind Gezeiten- oder Flachwasserbewohner, die eine hohe Toleranz bezüglich der Temperaturen und Salzgehalte ihres Lebensraumes haben. Sie sind in der Regel Allesfresser oder Generalisten und können mit einheimischen Tieren um Nahrung und Schutz konkurrieren. Die Fortpflanzungsrate ist zudem oft hoch.[64][66] Zwei der Arten, die Gemeine Strandkrabbe (Carcinus maenas) und die Chinesische Wollhandkrabbe (Eriocheir sinensis), wurden von der World Conservation Union (IUCN) in die Liste der 100 of the World’s Worst Invasive Alien Species aufgenommen.[67]
Die Chinesische Wollhandkrabbe wurde vermutlich Anfang des zwanzigsten Jahrhunderts durch Ballastwassereinleitungen nach Kontinentaleuropa gebracht. Dabei handelte es sich wahrscheinlich um Larven, die sich in den Flussmündungen ansiedelten und anschließend als Jungtiere stromaufwärts wanderten.[68] Auch die Blaukrabbe (Callinectes sapidus), ursprüglich heimisch an der Atlantikküste von Nordamerika und Südamerika sowie im Golf von Mexiko, wurde erst im letzten Jahrhundert nach Europa gebracht.[69] Erstmals wurde sie 1901 in Rochefort an der Atlantikküste Frankreichs entdeckt,[69] danach breitete sie sich sowohl nach Süden in das Mittelmeer bis an die israelische, griechische und nordafrikanische Küste[70] sowie auch nach Norden bis in die Nordsee sowie zuletzt 2023 auch in die Ostsee aus.[71]
Die Einschleppung von Krabben und anderen Arten kann durch verschiedene Wege erfolgen und insgesamt werden viel mehr gebietsfremde Arten versehentlich eingeschleppt als sich jemals etablieren können, da sie dafür eine stabile Population aufbauen müssen. Krebse können dabei sowohl als erwachsene Tiere wie auch im Larvenstadium auf verschiedene Weise transportiert werden. Die meisten meereslebenden Krabbenarten haben freischwimmende Larvenstadien (Zoea und Megalopa, siehe oben). Die Larven werden in Häfen mit dem Ballastwasser zur Stabilisierung des Schiffes aufgenommen, und dann an anderer Stelle wieder freigesetzt, wenn die Schiffe mit neuer Fracht beladen werden. Insgesamt beträgt das Gesamtvolumen des beförderten und larvenhaltigen Ballastwasser weltweit Hunderte von Millionen Tonnen pro Jahr, das ohne Sterilisation von einem Ort zu einem anderen verbracht wird.[72] Zudem können ausgewachsene Krebse auch als Schiffsrumpfbewuchs (Fouling) transportiert werden. Dieser Bewuchs ist ebenfalls ein bedeutender Vektor, da er Boote aller Größen betrifft.[72] Eher zufällig kam es zu einer Entdeckung der neuen Krabbengattung und -art Setozius incertus, die im Rumpfbewuchs auf einer in Singapur angedockten Ölplattform gefunden wurde. Die eigentlich Herkunft der Art blieb unbekannt, es wurde jedoch vermutet, dass der Bewuchs während des Einsatzes in der Timorsee und im Südchinesischen Meer entstanden ist.[73] Da Ölplattformen oft über lange Zeiträume verankert bleiben, können sich dort ganze Meeresgemeinschaften ansiedeln, die bei einem Transport an einen neuen Standort verschleppt werden können.[72]

Weitere Verbreitungswege für invasive Arten sind Kanäle, die verschiedene Meeresgebiete verbinden, der Transport von lebenden Meeresfrüchten, der Aquarienhandel, das Entweichen aus Aquakulturanlagen und das absichtliche Aussetzen zur Etablierung einer neuen Fischereiquelle.[72] Unter den Kanälen kommt dabei vor allem dem Suezkanal und dem Panamakanal eine besondere Rolle zu. Der 1869 eröffnete Suezkanal etwa verbindet das Rote Meer mit dem Mittelmeer und damit indirekt mit dem Atlantischen Ozean. Durch diesen Kanal haben seit seiner Eröffnung nachweislich 29 Arten das Mittelmeer kolonisiert, was 40 % der invasiven Krebse weltweit ausmacht.[72] Da der Suezkanal keine Schleusen und keine dazwischenliegenden Süßwasserseen hat, gibt es keine Hindernisse, die die Arten an der Wanderung in beide Richtungen behindern, durch die höhere Lage des Roten Meeres fließt allerdings der Nettostrom von Meerwasser in Richtung des Mittelmeeres. Vom Port Said aus verbreiten sich diese Arten dann weiter in das Mittelmeer.[72] Beim Panamakanal, der 1914 offiziell eröffnet wurde, gibt es durch einen erhöhten künstlichen Süßwassersee mit Schleusen an beiden Enden keine direkte Wanderroute, die Schiffe führen aber trotzdem Ballastwasser mit.[72] Auch Süßwasserkanäle können Einfluss auf die Ausbreitung invasiver Arten haben, etwa auf dem europäischen Festland und in Großbritannien im Fall der Wollhandkrabbe. Durch den Transport von lebenden Muscheln, in der Regel Austern, gab es weitere Einschleppungen wie etwa von Metacarcinus novaezelandiae von Neuseeland nach Tasmanien.[72]
Über die Auswirkungen von invasiven Krabbenarten gibt es nur eine begrenzte Anzahl Untersuchungen. Dies liegt vor allem daran, dass die Tiere in der Regel wenig Aufmerksamkeit auf sich ziehen und erst fast zu einem Schädling werden müssen, bevor eine entsprechende Untersuchung ihrer möglichen Auswirkungen vorgenommen wird. Die unter anderem in Südafrika, Australien und an die Atlantik- und Pazifikküste Nordamerikas eingeführte Gemeine Strandkrabbe etwa ernährt sich unter anderem von Muscheln und gilt daher als potenzielle Bedrohung für Zuchtmuscheln und Austern. Sie konkurriert dabei in Nordamerika mit einheimischen Arten wie Hemigrapsus oregonensis und der dort ebenfalls eingeführten Asiatischen Strandkrabbe (Hemigrapsus sanguineus) um Nahrung. Im Gegensatz dazu wurde Charybdis japonica im Norden Neuseelands nachgewiesen, wo sie mit der heimischen Schaufelkrabbe (Ovalipes catharus) um einheimische Muscheln konkurriert. Ihr Verbreitungsgebiet konnte sich innerhalb der ersten zehn Jahre von Auckland bis Whangarei um eine Entfernung von etwa 140 Kilometern ausdehnen.[74]
Abstammungsgeschichte

Die Kronengruppe der Zehnfußkrebse wird mehrheitlich in das Devon (vor 419–359 Millionen Jahren [mya]) datiert. Eine Studie aus dem Jahr 2019 ermittelte einen früheren gemeinsamen Vorfahren, nämlich im späten Ordovizium vor etwa 455 mya. Krabben spalteten sich vermutlich im Karbon (358,9–298,9 mya) von den Mittelkrebsen (Anomura) ab. Die erste Aufspaltung der Krabben durch Abspaltung der Dromiacea begann im späten Trias vor gut 200 mya.[75] Die Eubrachyura reichen auf das mittlere Jura (183–161 Ma) zurück,[23] die Teilung in Hetero- und Thoracotremata fand in der frühen Kreidezeit statt.[75] Die Herausbildung der Diversität innerhalb der Krabben begann in der späten Kreidezeit.[76] In dieser als „Cretaceous Crab Revolution“ („kreidezeitliche Krabben-Revolution“) bezeichneten Periode vor 145 bis 66 Mya traten kurzzeitig viele mittlerweile ausgestorbene Linien, aber auch die meisten der heutigen Überfamilien auf.[23] Einige dieser ausgestorbenen Taxa der Kreidezeit kamen nachweislich bereits in nichtmarinen Lebensräumen vor, sodass geschlossen werden kann, dass bereits früh neue Lebensräume vor allem im Süßwasser besiedelt wurden.[23][24][77]
Die ältesten Fossilien von Krabben stammen aus dem frühen Jura.[23] Am besten bleiben stark mineralisierte Körperteile wie Scheren und Mundwerkzeuge erhalten, der Abbau des Chitins durch Bodenlebewesen ist limitierend für den Erhalt, der geringer ist als der anderer Lebewesen mit Kalkschale wie Muscheln. Ein weiteres Phänomen ist, dass Fossilfunde häufig nur Exuvien sind, also die abgestoßene Außenhülle bei der Häutung. Die Schwierigkeit der Systematik und der Zuordnung zu rezenten Taxa besteht darin, dass Bestimmungsmerkmale wie die Maxillipeden oder die Morphologie der Fortpflanzungsorgane bei Fossilien entweder nicht erhalten oder nicht sichtbar sind. Man verwendet heute vor allem die Form des Carapax für die Zuordnung zu höheren Taxa. Es sind sieben ausgestorbene Überfamilien beschrieben, zwei Familien sind ohne gesicherte Zuordnung (incertae sedis), weitere ausgestorbene Familien treten auch in rezenten Überfamilien auf. Darüber hinaus gibt es auch Fossilfunde von rezenten Arten.[78]
Systematik
Externe Systematik
Die Krabben bilden die artenreichste Gruppe innerhalb der Zehnfußkrebse (Decapoda), wo sie gemeinsam mit weiteren Krebsgruppen in die Pleocyemata eingeordnet werden.[79] Am nächsten sind sie mit den Mittelkrebsen (Anomura) verwandt. Mittelkrebse und Krabben haben verschiedene Synapomorphien wie das kurze asymmetrische Flagellum der Antennule, die gebogenen Exopoden der Maxillipeden und die Verschmelzung von Ganglien.[75] Bei den relativ heterogenen Mittelkrebsen sind nur einige Familien krabbenähnlich. Wesentliche Unterschiede zu den Krabben sind, dass Mittelkrebse ein stark reduziertes letztes Beinpaar haben, das Epistom nicht mit den Grundgliedern der beiden Antennen verschmilzt, das achte Sternit nicht mit den anderen sieben verwachsen ist und das Pleon nicht oder nur wenig unter den Carapax geklappt ist.[80]
Kontrovers wird diskutiert, ob die von Scholtz und Richter 1995 eingeführte gemeinsame Stammform von Krabben und Mittelkrebsen, die Meiura,[81] monophyletisch ist. Nachdem mehrere Studien anhand von DNA-Sequenzierungen dies bezweifelten, scheinen neuere Analysen die Monophylie der Meiura wieder zu bestätigen.[75][82] Im World Register of Marine Species werden die Meiura allerdings aktuell als „nicht akzeptiert“ (unaccepted) geführt.[83]
Interne Systematik
Die klassische Systematik basierte auf der Form des Rückenschilds und der Mundwerkzeuge. Diese Merkmale sind aber starken konvergenten Entwicklungen unterworfen, so dass nicht zur Klassifizierung geeignet sind. Ab den 1970er Jahren wurden verstärkt innere Merkmale des Fortpflanzungssystems herangezogen, vor allem die Position der Geschlechtsöffnung (Gonopore, siehe oben). Hierbei werden traditionell die Podotremata, Heterotremata und Thoracotremata unterschieden. Die Podotremata sind allerdings eine paraphyletische Gruppe und fassen mit den Dromiacea, den Homoloida, den Raninoida und den Cyclodorippoida mehrere ursprüngliche Krabbentaxa.[84][76][75]
Die monophyletischen Thoracotremata werden auch als „höhere Krabben“ bezeichnet. Die hohe Variabiltät morphologischer Merkmale innerhalb der Krabben und die vermutete starke Präsenz abgeleiteter Merkmale erschweren die systematischen Untersuchungen. Die neueren systematischen Ansätze schließen daher neben morphologischen Merkmalen auch genetische Untersuchungen ein. Hier besteht noch viel Forschungsbedarf und die Systematik könnte in näherer Zukunft größeren Veränderungen unterliegen.[76] Die phylogenetischen Beziehungen vieler Familien und Überfamilien werden nach wie vor kontrovers betrachtet, insbesondere die innerhalb der Thoracotremata und die Position der Hymenosomatoidea.[21] Nach dem aktuellen Stand der Diskussion werden die folgenden Sektionen und Überfamilien innerhalb der Krabben unterschieden:[85]

- Sektion Cyclodorippoida (Ahyong, Lai, Sharkey, Colgan & Ng, 2007)
- Überfamilie Cyclodorippoidea (Ortmann, 1892)
- Sektion Dromiacea (de Haan, 1833)
- Überfamilie Dromioidea (de Haan, 1833)
- Überfamilie Homolodromioidea (Alcock, 1900)
- Sektion Homoloida (Karasawa, Schweitzer & Feldmann, 2011)
- Überfamilie Homoloidea (de Haan, 1839)
- Sektion Raninoida (de Haan, 1839)
- Überfamilie Raninoidea (de Haan, 1839)
- Sektion Eubrachyura (de Saint Laurent, 1980)
- Untersektion Heterotremata (Guinot, 1977)
- Überfamilie Aethroidea (Dana, 1851)
- Überfamilie Bellioidea (Dana, 1852)
- Überfamilie Bythograedoidea (Williams, 1980)
- Überfamilie Calappoidea (Milne Edwards, 1837)
- Überfamilie Cancroidea (Latreille, 1802)
- Überfamilie Carpilioidea (Ortmann, 1893)
- Überfamilie Cheiragonoidea (Ortmann, 1893)
- Überfamilie Corystoidea (Samouelle, 1819)
- Überfamilie Dairoidea (Serène, 1965)
- Überfamilie Dorippoidea (Macleay, 1838)
- Überfamilie Eriphioidea (Macleay, 1838)
- Überfamilie Gecarcinucoidea (Rathbun, 1904)
- Überfamilie Goneplacoidea (Macleay, 1838)
- Überfamilie Hexapodoidea (Miers, 1886)
- Überfamilie Hymenosomatoidea (Macleay, 1838)
- Überfamilie Leucosioidea (Samouelle, 1819)
- Überfamilie Majoidea (Samouelle, 1819)
- Überfamilie Orithyioidea (Dana, 1852)
- Überfamilie Palicoidea (Bouvier, 1898)
- Überfamilie Parthenopoidea (MacLeay, 1838)
- Überfamilie Pilumnoidea (Samouelle, 1819)
- Überfamilie Portunoidea (Rafinesque, 1815)
- Überfamilie Potamoidea (Ortmann, 1896)
- Überfamilie Pseudocarcinoidea (Ng & Davie, 2020)
- Überfamilie Pseudothelphusoidea (Ortmann, 1893)
- Überfamilie Pseudozioidea (Alcock, 1898)
- Überfamilie Retroplumoidea (Gill, 1894)
- Überfamilie Trapezioidea (Miers, 1886)
- Überfamilie Trichodactylidae (H. Milne-Edwards, 1835)
- Überfamilie Trichopeltarioidea (Tavares & Cleva, 2010)
- Überfamilie Xanthoidea (MacLeay, 1838)
- Untersektion Thoracotremata (Guinot, 1977)
- Überfamilie Aphanodactyloidea (Ahyong & Ng, 2009)
- Überfamilie Cryptochiroidea (Paulson, 1875)
- Überfamilie Grapsoidea (MacLeay, 1838)
- Überfamilie Gecarcinucoidea (Rathbun, 1904)
- Überfamilie Ocypodoidea (Rafinesque, 1815)
- Überfamilie Pinnotheroidea (de Haan, 1833)
- Untersektion Heterotremata (Guinot, 1977)
Menschen und Krabben
Wirtschaftliche Nutzung

Funde auf dem Gebiet des heutigen Eritreas aus dem Pleistozän zeigen, dass Krabben an den Küsten früh auf dem Speiseplan von Menschen standen.[86] Auch noch heute werden zahlreiche, vor allem größere Arten der Krabben vom Menschen kommerziell gefangen und als Nahrungsmittel genutzt. Die bei der Krabbenfischerei in der Nordsee gefangenen „Nordseekrabben“ sind allerdings zoologisch gesehen keine Krabben, sondern Nordseegarnelen, die zur Teilordnung Caridea gehören. Da bei Krabben, anders als bei Garnelen und anderen Krebsen, kein muskulöser Hinterleib vorhanden ist, spielen bei ihnen vor allem die muskulösen Extremitäten und von diesen vor allem die Scherenbeine eine zentrale Rolle als Fleischquelle, der restliche Krabbenkörper enthält dagegen keine Muskulatur. Besonders geschätzt werden in den Vereinigten Staaten die als „peelers“ bezeichneten Krabben unmittelbar nach der Häutung, bei denen der Panzer noch nicht ausgehärtet ist und nicht aufgeknackt, sondern nur geschält werden muss.[86] Krabbenfleisch besteht aus hochwertigem Eiweiß, ist arm an Fetten und Kohlenhydraten, reich an Spurenelementen wie Kupfer, Selen und Magnesium sowie an Vitamin B12.[87] Die jüdischen Speisegesetze verbieten allerdings den Verzehr von Krabben, da sie als Meerestiere weder Flossen noch Schuppen haben (Deuteronomium 14,10 ). Im Christentum wird diese Weisung aus dem Alten Testament meist ignoriert, lediglich die meisten Siebenten-Tags-Adventisten richten sich noch nach ihr.[86]
Hepatopankreas und Gonaden werden als „brown crab meat“ vor allem für die Herstellung von Krabbenpaste verwendet. Ab den 1870er Jahren begann der Unternehmer James McMenamin in Hampton (Virginia) Krabben in Dosen zu konservieren. Die Stadt war bald als „Crabtown“ bekannt und machte Krabbenfleisch auch für Bewohner weitab der Küsten erschwinglich. Später wurde auch pasteurisiertes Krabbenfleisch in Plastik verpackt, was allerdings eine stetige Kühlung erfordert.[86]
| Protein | 19 g |
| Fette (davon mehrfach ungesättigte Fettsäuren) | 1,1 g (0,4 g) |
| Kohlenhydrate | 1 g |
| Vitamin B1 | 0,41 mg |
| Vitamin B3 | 3,1 mg |
| Vitamin B12 | 8,9 mg |
| Selen | 41 mg |
| Kupfer | 0,6 mg |
| Zink | 4,7 mg |
| Eisen | 0,35 mg |
| Magnesium | 17–21 mg |
Im Krabbenfang dominieren in den gemäßigten Breiten Gemeine Strandkrabbe, Taschenkrebs und Europäische Winkerkrabbe, in Nordamerika Kalifornischer Taschenkrebs, Große Stein-, Blau-, Schnee- und Tanner-Krabbe.[88][87] Bei einigen Arten (Taschenkrebs, Große Steinkrabbe, Europäische Winkerkrabbe) wird regional in der kommerziellen Fischerei den Krabben nur eine oder beide Scheren abgenommen und sie dann ins Meer zurückgesetzt. Diese als „nachhaltig“ propagierte Form der Fischerei geht davon aus, dass sich die Scheren wieder nachwachsen. Allerdings ist die Überlebensrate der zurückgesetzten Tiere relativ gering, vor allem wenn beide Scheren amputiert werden.[89] Die wichtigsten Krabben im kommerziellen Krabbenfang und in der Produktion in Aquakulturen sind im indopazifischen Raum die vier Arten der Gattung Scylla.[90] Die Rote Schneekrabbe wird in Korea und Japan mit Fallen gejagt, die Chinesische Wollhandkrabbe in China und Korea in großem Umfang in Aquakulturen gezüchtet.[91] 2015 wurden fast 1,3 Millionen Tonnen Krabben gefangen oder gezüchtet.[92] 2024 wurden allein in China 1,177 Millionen Tonnen in Aquakulturen produziert, davon 880.600 t Süßwasserkrabben.[93]
In den an Meeren gelegenen Staaten in Europa werden vor allem Taschenkrebse auf vielfältige Weise verarbeitet. In den Vereinigten Staaten ist „crabmeat“ beliebt, das ebenfalls aus dem Fleisch von Taschenkrebsen oder anderen Krabben hergestellt und in Dosen verkauft wird. Auch in asiatischen Ländern und in Australien gibt es zahlreiche Zubereitungsformen für Krabben. Es gibt auch Krabbenfleisch-Imitate aus Fischfleisch, die als Surimi bezeichnet werden.
-
 Sapateira, Taschenkrebs in Portugal
Sapateira, Taschenkrebs in Portugal -
_sj%C3%B8kreps_(Nephrops_norvegicus)_reker_(Pandalus_borealis)_Vestfold._Cooked_sea_food_Edible_crab_Langoustine_Shrimp_Norway_September_2021IMG_1856.jpg) Norwegische Meeresfrüchte mit Taschenkrebsen
Norwegische Meeresfrüchte mit Taschenkrebsen -
.jpg) Toast mit Krabbenfleisch in Dänemark
Toast mit Krabbenfleisch in Dänemark -
 Ganjang gejang, marinierte Krabben in Südkorea
Ganjang gejang, marinierte Krabben in Südkorea -
.jpg) Black pepper crab in Singapore
Black pepper crab in Singapore -
 Kepiting saus padang (Krabbe in Padang-Sauce) in Indonesien
Kepiting saus padang (Krabbe in Padang-Sauce) in Indonesien -
.jpg) Kobako Krabben-Sushi in Japan mit Krabbenfleisch und -eiern
Kobako Krabben-Sushi in Japan mit Krabbenfleisch und -eiern -
 ‚claw fingers‘, in den USA als Garnitur oder Horsd’œuvre serviert
‚claw fingers‘, in den USA als Garnitur oder Horsd’œuvre serviert
Die Chitinteile von Krabben und anderen Krebsen werden zur Herstellung des Aminozuckers Glucosamin verwendet, welcher als Nahrungsergänzungsmittel vor allem bei Arthrosen eingesetzt wird.[86] Ein tatsächlicher Nutzen dieser Substanz für die Gelenkgesundheit ist jedoch wissenschaftlich nicht bewiesen.[94]
Gesundheitliche Bedeutung

Das Fleisch einiger Krabben ist giftig, beispielsweise das der Olivgrünen Steinkrabbe (Atergatis floridus) und der Giftigen Riffkrabbe (Zosimus aeneus). Es enthält Gifte wie Saxitoxin, Tetrodotoxin und Palytoxin, die allerdings nicht von den Krabben selbst, sondern von Dinoflagellaten, Mikroalgen, Makroalgen, Cyanobakterien und Kieselalgen der Gattung Diatoma produziert werden. Krabben selbst haben eine hohe Toleranz gegenüber diesen Toxinen.[95] Aber auch andere Krabbenarten können Algentoxine ansammeln, wie bei der Algenblüte 2015 in Kalifornien.[86] Bei Gewässerbelastung mit Schwermetallen reichern sich diese in Krabben an. Hierbei können vor allem für Methylquecksilberverbindungen beim täglichen Verzehr toxikologisch relevante Mengen zusammenkommen. Beim Taschenkrebs im Bereich der Azoren und bei der Tasmanischen Riesenkrabbe konnten Gehalte von bis zu 1,2 mg/kg ermittelt werden.[96]
Wie viele Meeresfrüchte ist Krabbenfleisch ein sehr sensibles Lebensmittel. Das gilt insbesondere für ungenügend erhitztes Fleisch oder bei unterbrochener Kühlkette. Es kann mit auch für den Menschen pathogene Erreger wie Vibrio parahaemolyticus, Salmonellen, Escherichia coli und Listeria monocytogenes kontaminiert sein.[97][98] Allein in den Vereinigten Staaten gibt es jährlich 92.400 Lebensmittelinfektionen durch Vibrio parahaemolyticus, die meisten durch ungenügend erhitzte Meeresfrüchte.[97] Für Lungenegel der Gattung Paragonimus sind Krabben Zwischenwirt, der Mensch steckt sich durch den Verzehr von nicht ausreichend erhitztem Fleisch von Krabben und anderen Krebstieren an, in Korea, Japan und Teilen Afrikas wird rohes Krabbenfleisch auch in der Traditionellen Medizin verwendet. Paragonimus-Infektionen kommen vor allem in Ostasien, Mittel- und Südamerika und Afrika vor.[99]
Krabbenfleisch kann, wie andere Eiweißprodukte, Nahrungsmittelallergien auslösen. Das auslösende Allergen ist meist das Muskelprotein Tropomyosin, dass sich in der Primärstruktur von dem der Wirbeltiere unterscheidet, aber innerhalb der Wirbellosen sehr ähnlich ist, so dass meist eine Kreuzreaktivität auch zu anderen „Schalentieren“ besteht. Etwa 0,5 bis 2,5 % der Bevölkerung reagieren auf Schalentiere allergisch, womit sie zu den häufigsten Allergenen gehören. Die Allergie kann als Anaphylaxie akut lebensbedrohlich verlaufen oder sich in Juckreiz und Entzündungen der Haut und Schleimhäute zeigen.[86]
Bedrohung und Schutz
Insgesamt sind Krabben weniger bedroht als andere Krebstiere. In der ersten Online-Ausgabe der Roten Liste gefährdeter Arten der IUCN aus dem Jahre 1996 waren nur sieben Arten als gefährdet eingestuft.[100] Bedroht sind vor allem Arten mit eng begrenztem Verbreitungsgebiet und wegen des Verlusts des Lebensraums vor allem Süßwasserarten. Zwei der in der aktuellen Datenbank der IUCN als stark gefährdet (critically endangered) eingestuften Arten, Karstama balicum und Karstama emdi, kommen nur in einer einzigen Karsthöhle auf Bali vor, wo sie durch religiöse Zeremonien im dortigen Tempel und zunehmendem Tourismus gestört werden.[101] Alle der 39 derzeit als stark gefährdet geltenden Arten sind Süßwasserbewohner, allein 26 davon sind nur auf Sri Lanka heimisch, fünf treten in Afrika und nur je eine in Mittel- und Südamerika auf.[102] Süßwasserkrabben sind durch Abholzung der Regenwälder, veränderte hydrologische Bedingungen und Umweltverschmutzung besonders stark betroffen.[103] Bei einigen Krabbenarten kommen auch Veränderungen des Habitats durch den Klimawandel hinzu.[104]
| Überfamilie | Arten |
|---|---|
| Gecarcinucoidea | Ceylonthelphusa callista, C. durrelli, C. kotagama, C. nana, C. nata, C. orthos, C. sanguinea, C. savitriae, Clinothelphusa kakoota, Mahatha helaya, M. iora, M. lacuna, M.regina, Oziothelphusa dakuna, O. kodagoda, Parathelphusa reticulata, Perbrinckia cracens, P. enodis, P. fido, P. gabadagei, P. glabra, P. morayensis, P. punctata, P. quadratus, P. rosae, P. scitula, Phricotelphusa hockpingi |
| Grapsoidea | Karstama balicum, K. emdi |
| Potamoidea | Afrithelphusa afzelii, A. leonensis, Geothelphusa tawu, Liberonautes grandbassa, L. lugbe |
| Pseudothelphusoidea | Strengeriana antioquensis, Tehuana veracruzana |
Marine Krabbenarten der tropischen Gezeitenzone sind vor allem durch den Verlust der Mangrovenwälder bedroht. Diese wurden vielerorts gerodet und dafür Teiche für Aquakulturen angelegt. In jüngerer Zeit gibt es allerdings einen Gegentrend, indem die Krabbenzucht extensiv unter natürlichen Bedingungen (Silvikultur) betrieben wird und Mangrovenwälder dafür wieder aufgeforstet werden.[90] Eine weitere Bedrohung für die Krabbenbestände ist die Überfischung. Dieser Gefahr wird seitens der Fischereibehörden durch regionale Begrenzung der Fangmengen wie beispielsweise bei der Tasmanischen Riesenkrabbe[105] und bei Schneekrabben[106] oder durch Mindestgrößen wie bei der Großen Steinkrabbe[89] oder der Tanner-Krabbe[86] begegnet.
Krabben in Kultur und Kunst
Grundsätzlich werden Krebstiere seit mindestens 3500 Jahren in künstlerischen Darstellungen gezeigt. Mit wenigen Ausnahmen wurden dabei große und häufig gefangene, essbare Zehnfußkrebse dargestellt, neben Krabben entsprechend vor allem Hummer, Garnelen und andere Großkrebse. Dabei ist ihre Rezeption deutlich seltener als bei Wirbeltieren oder Insekten und ihre Darstellung in der Kunst war meistens eher unauffällig.[107] In zwei historischen Epochen, der Römerzeit und dem „Goldenen Zeitalter“ der Niederlande und Flanderns im 17. Jahrhundert, kamen sie häufiger vor als in anderen Epochen.[107]
Krabben tauchen in unterschiedlicher Weise auf, häufig ist ihre Rezeption dabei vor allem in der Kunst auf ihre Rolle als Nahrungsmittel etwa auf Stillleben mit Meeresfrüchten beschränkt. Daneben werden sie aber auch in anderen Bereichen und Kontexten dargestellt, die weniger offensichtlicher sind und menschliche Belange wie Sex, Ästhetik und Religion in symbolischer Weise aufgreifen. Wenn ihre Verbindung mit Nahrung, Wasser und dem Tierkreis logisch erscheint, so sind einige ihrer anderen symbolischen und gelegentlich antagonistischen Positionen überraschender.[107] In der Englischen Sprache bezeichnet das Adjektiv ‚crabby‘ (von englisch crab ‚Krabbe‘) eine schlecht gelaunte Person, ist aber schon im Mittelenglisch des 13. Jahrhunderts als ‚crabbed‘ in Gebrauch. In William Shakespeares Zwei Herren aus Verona (um 1590/91) heißt der notorisch illoyale Hund Crab.[108]
Krabbendarstellungen in der Antike
.jpg)
Zu den ältesten bekannten Darstellungen von Krebstieren gehören Reliefs mit Meerestieren aus den Alten Ägypten sowie aus dem Assyrischen Reich. So existiert ein aus dem 8. Jahrhundert vor unserer Zeitrechnung stammendes und heute in der Sammlung des Pariser Louvre befindliches Relief, dass den Transport von Zedernholz über das Meer darstellt, aus einem Palast aus der assyrischen Stadt Dur Šarrukin. Dieses zeigt neben mehreren Booten und Menschen auch zahlreiche Meerestiere, darunter auch zwei oder drei Krabben.[107]
In der griechischen Mythologie ist die Krabbe ein wilder, ergebener, aber auch verwundbarer Soldat. Sie ist loyal, wohlmeinend, ein bisschen tollpatschig, aber immer nur Nebenfigur.[108] So schickt Hera die große Krabbe Karkinos zur Unterstützung der Hydra im Kampf gegen Herakles. Karkinos beißt Herakles in die Ferse, wird jedoch von ihm getötet; entsprechend taucht Karkinos als Krabbe oder ähnlicher Krebs in zahlreichen Darstellungen des Hydrakampfes auf. Der Sage nach erhob Hera Karkinos für seinen Mut als Sternbild Krebs (altgriechisch καρκίνος Karkínos, lateinisch Cancer) in den Himmel, von dem auch das gleichnamige Tierkreiszeichen abgeleitet ist. Sein astrologisches Zeichen (♋) ist den Krabbenscheren nachempfunden,[109] zudem wird der Krebs als Krabbe in astrologischen Darstellungen des Sternbildes genutzt. Da das Sternbild des Krebses zudem das „Haus des Mondes“ symbolisiert, kommt ein Krebs auch bei verschiedenen astrologischen Darstellungen des Mondes vor.[110]
In einer anderen griechischen Sage beauftragt Poseidon eine unsterbliche riesige Krabbe namens Crios, seine 50 Töchter zu bewachen. Als sich einige davonschleichen, bittet Crios den Riesentintenfisch Vamari um Hilfe, der allerdings die aufgespürten Nymphen verschlingt. Crios erkennt den Verrat, attackiert Vamari und wird dabei schwer verletzt. Poseidon befreit Crios in Anerkennung der Dienste von ihren Schmerzen und versetzt die Krabbe in den Himmel, wählt dafür aber einen bescheidenen Platz zwischen den viel helleren Sternbildern Löwe und Zwillinge.[108]
In Griechenland gab es zudem Drachmenmünzen mit der Darstellung eines Krebses, die unter anderem in großer Zahl in Akragas gefunden wurden.
-
 Antike griechische Vase, die den Angriff der Krabbe Karkinos auf Herakles zeigt
Antike griechische Vase, die den Angriff der Krabbe Karkinos auf Herakles zeigt -
.jpg) Detail der Krabbe Karkinos auf einer antiken Vase aus der etruskischen Stadt Caere
Detail der Krabbe Karkinos auf einer antiken Vase aus der etruskischen Stadt Caere -

-
Ausschnitt aus dem Mosaik Ozeanboden (1. Jh. v. Chr.), Archäologisches Museum Populonia
Auch in der Römischen Kunst gab es Darstellungen von Krebstieren und darunter häufig auch Krabben. Die Meeresfauna des Mittelmeers war vom Ende des 2. Jahrhunderts vor unserer Zeitrechnung bis zum 4. Jahrhundert ein fester Bestandteil der römischen Kunst, wobei vor allem Fische neben Weichtieren, Tintenfischen, Quallen und auch Krebstieren in Mosaiken, Wandmalereien und Keramiken dargestellt wurden. In den etwa tausend Jahren nach der Römerzeit nahm die Häufigkeit von Krustentieren in der westlichen Kunst mit wenigen Ausnahmen drastisch ab. Frühchristliche Ringe und anderer Schmuck ab dem 2. Jahrhundert waren vor allem mit Fischen als grundlegendes christliches Tiersymbol verziert, während Krebsdarstellungen selten waren.[107]
Vom Mittelalter bis in die Moderne Kunst

Im westlichen Mittelalter gab es grundsätzlich nur vergleichsweise wenige Darstellungen von Tieren und die Kunst dieser Zeit war fast ausschließlich auf religiöse Themen ausgerichtet. Allerdings wurde das Thema der Tierkreiszeichen populär und Krabben wie andere Krebse wurden verwendet, um das Zeichen des Krebses in Büchern, auf Skulpturen und Reliefs oder auch in Buntglasfenstern darzustellen.[107] Krabben wurden zudem als „das Böse“ betrachtet und standen für Betrug, Grausamkeit, Unbeständigkeit und Gier. Isidor von Sevilla behauptete, dass Skorpione aus Krabben entstehen. Im Bestiarium von Cambridge aus dem frühen 13. Jahrhundert wird beschrieben, dass die Krabbe zu einem Trick greift, um eine Auster zu fressen: sie wirft einen Stein in die Auster um zu verhindern, dass diese sich schließt. Dies steht als Warnung, dass Betrug und Durchtriebenheit zur Sünde verführen.[109]
Nachdem christliche Gelehrte wie Thomas von Aquin und Roger Bacon das theologische Denken mit der Erfahrung der Natur verbanden, wurden in der Kunst im 14. und 15. Jahrhundert auch wieder vermehrt Bilder aus der Natur verwendet. Vereinzelt gab es darunter auch Bilder von Krebsen, darunter etwa eine Krabbendarstellung von Albrecht Dürer aus dem Jahr 1495. Zudem wurden Krabben erneut zut Darstellung der Tierkreiszeichen aufgenommen, etwa in den Kalenderblättern im Stundenbuch des Herzogs von Berry (Les Très riches heures du Duc de Berry), die von den Brüder von Limburg zwischen 1408 und 1416 ausgeführt wurden.[107]
-
 Kalenderblatt des Stundenbuch des Herzogs von Berry, 1408 bis 1416
Kalenderblatt des Stundenbuch des Herzogs von Berry, 1408 bis 1416 -
 Pieter Bruegel der Ältere: Die großen Fische fressen die kleinen (1556)
Pieter Bruegel der Ältere: Die großen Fische fressen die kleinen (1556) -
 Giuseppe Arcimboldo: Aqua (1566) mit einer Krabbe unten links
Giuseppe Arcimboldo: Aqua (1566) mit einer Krabbe unten links -
 Stich des Sternbildes Krebs (1782)
Stich des Sternbildes Krebs (1782)

.jpg)
Mit der Renaissance und dem Rückgriff auf die klassische Kunst, rückten vor allem in der italienischen und der flämischen Kunst naturalistische Motive wie vor allem Blumen- und Obstgemälde sowie später auch Tiere, vor allem Landtiere, als Zeichen des Realismus in den Mittelpunkt. Nur selten sind in diesen Bildern Krebstiere zu finden, einzelne Werke wie Die großen Fische fressen die kleinen von Pieter Bruegel der Ältere von 1556 und Das Wasser von Jan Brueghel der Ältere von 1611 stellen Ausnahmen dar.[107] Der italienische Maler Giuseppe Arcimboldo nutzte bei der Darstellung des Wassers (Aqua) in seinen Porträts der Vier Elemente von 1566 eine große Krabbe zur Darstellung des Brustbereichs.[107]
Während dem Goldenen Zeitalters der niederländischen und flämischen Malerei im 17. Jahrhundert wurden vor allem Genrebilder und Stillleben als respektable Kunstformen allgemein anerkannt. Vor allem Stillleben rückten in den Mittelpunkt und da Flandern sowie die Niederlande durch die Fischerei und den Handel eine starke Verbindung zum Meer hatten, wurde auch das Leben im Meer vor allem als Nahrungsquelle in Stillleben dargestellt. Neben Tischstillleben gab es auch ein wachsende Interesse an der Naturkunde, das sich in Gemälden von Kuriositätenkabinetten des 17. Jahrhunderts widerspiegelte. Zugleich wurde die Tradition der Bodegones-Malerei vor allem durch Diego Velázquez fortgesetzt. Baltasar Gomes Figueira, ein in Spanien ausgebildeter portugiesischer Maler, fertigte einige Bodegones an, auf denen auch verschiedene Krebse zu sehen sind. Der Einfluss dieser Zeit reichte bis weit in das 19. und 20. Jahrhundert, wobei allerdings Krebstiere selten abseits der niederländischen Malerei vorkamen.[107]
In der Kunst des 19. bis 20. Jahrhunderts kommen Darstellungen von Krabben und generell von Krebsen nur sporadisch vor. So malte auch der belgische Maler James Ensor mehrfach Stillleben mit Krebsen[107] und sein niederländischer Kollege Vincent van Gogh malte im Jahr 1889 mehrere Bilder von Krabben, beispielsweise sein Gemälde Zwei Krabben, das sich heute in der National Gallery in London befindet, und einen Krebs, auf dem Rücken liegend, heute im Van Gogh Museum in Amsterdam. Max Ernst malte 1926 sein Bild Die Krabbe, das sich im Museum für Moderne Kunst in Brüssel befindet.[107]
-
 Pieter Claesz: Stillleben mit einem Römer, einer Krabbe und einer geschälten Zitrone (1643)
Pieter Claesz: Stillleben mit einem Römer, einer Krabbe und einer geschälten Zitrone (1643) -
 William Adolphe Bouguereau: Die Krabbe (1869)
William Adolphe Bouguereau: Die Krabbe (1869) -
 Vincent van Gogh: Krebs, auf dem Rücken liegend (1889)
Vincent van Gogh: Krebs, auf dem Rücken liegend (1889) -
 James Ensor: Stillleben mit Hummer und Krabbe (1890)
James Ensor: Stillleben mit Hummer und Krabbe (1890)
Außereuropäische Kunst und Kultur
Im Nahen Osten gab es mit der Ausbreitung des Islam im Zeitraum vom 8. bis zum 12. Jahrhundert ein reges Interesse an Wissenschaft und Kunst, womit auch Krebstiere eine Rolle bei der Darstellung von Tieren in Wandmalereien, Keramiken und Büchern spielten.[107]

Im Buddhismus stehen Krabben für die Zeit zwischen Tod und Wiedergeburt. In China sind Krabben wegen ihres wohlschmeckenden und nahrhaften Fleisches seit Jahrhunderten geschätzt, weshalb sie häufig in der chinesischen Poesie und Prosa vorkommen. Die seitliche Fortbewegung der Krabben wird als Symbol der Unehrlichkeit betrachtet.[109] Auch das kuriose Aussehen wird als satirische Metapher genutzt, zum Beispiel von Xu Wei. Einen Höhepunkt erreichte die Krabbendarstellung in der Tang-Dynastie, in der Complete Collection of Tang Poetry gibt es zahlreiche Gedichte renommierter Dichter wie Li Bai (701–762), Zhang Zhihe (732–774), Liu Zongyuan (773–819) und Du Mu (803–852) zu diesem Thema. Hier wird nicht nur die Schmackhaftigkeit besungen, sondern auch die Krabbe metaphorisch für negative Charaktere herangezogen. In der Song-Dynastie beschrieb Liu Ban in einem Gedicht nicht nur den Herbstfang, sondern nutzte die Krabbe auch als satirisches Mittel für die bösen Folgen der Tyrannei. Su Shi schätzte nicht nur den Verzehr von Krabben, sondern widmete ihnen zahlreiche Gedichte und Bilder. Die Complete Collection of Song Poem enthält 891 Werke mit Krabbenthematik, die Complete Collection of Song Ci-poem 82. Letztere lässt erkennen das in dieser Zeit das Verschenken von eingelegten Krabben beliebt war. In der Ming- und Qing-Dynastie gab es eine Stabilisierung der sozialen Verhältnisse und die Krabbenkultur wurde wiederbelebt. Aus der Ming-Zeit stammt auch das Gedicht Inscription Crab von Xu Wei und in einem Gemälde nutzte er Krabben als Bildnis, um sich über die inkompetenten Feudalherren lustig zu machen. In Dream of Red Mansions von Cao Xueqin, einem der großen Meisterwerke der chinesischen Literatur, wird der Verzehr von Krabben vielfach erwähnt. Sun Zhilu sammelte in drei Werken alle verfügbaren Informationen zu Krabben, von historischen Wurzeln, Verzehrstabus, emotionalen Assoziationen bis zur Literatur. In der chinesischen Malerei sind Krabben ein bedeutendes Motiv. Künstler verbanden sie mit Gefühlen, die Stolz, Frustration, Satire und Selbstironie vermitteln. Herausragend sind vor allem die Werke Xu Weis aus der Ming-Dynastie, in denen er häufig Krabben als Sinnbild zur Kritik der gesellschaftlichen Verhältnisse nutzte, als Meisterwerk gilt diesbezüglich Golden Armor Chart. Auch die Tuschezeichnungen Shen Zhous und Zhang Pans sind besonders fein ausgearbeitete Darstellungen von Krabben. Von den modernen Künstlern gilt Qi Baishi als einer der Meister der Krabben-Malerei. Auch in der Bildhauerei Chinas sind Krabben häufig vertreten, besonders bekannt sind die zahlreichen Skulpturen im Ba Jie Park in Kunshan und im Wuhu Riverside Park in Wuhu.[93]
-
 Keramikvase des Japaners Miyagawa Toranosuke (1881)
Keramikvase des Japaners Miyagawa Toranosuke (1881) -
 Einer Krabbe nachempfundenes Gebäude nahe Dagupan (Philippinen)
Einer Krabbe nachempfundenes Gebäude nahe Dagupan (Philippinen) -
 Hirsutodynomene vespertilio auf einer philippinischen Briefmarke
Hirsutodynomene vespertilio auf einer philippinischen Briefmarke

Auch in der japanischen Kultur spielen Krabben wegen ihrer kulinarischen Bedeutung eine große Rolle. Besondere Bedeutung hat die Krabbenart Heikegani (Heikea japonica). Ihre Rückenzeichnung ist eine Pareidolie für das Gesicht eines wütenden Samurais. Diese Krabben werden im Volksglaube als Reinkarnationen der in der Seeschlacht von Dan-no-ura (1185) unterlegenen Heike-Krieger angesehen. Sie werden, obwohl essbar, von vielen Japanern auch heute nicht gegessen.[111] In Korea wird vor allem die Rote Schneekrabbe (Chionoecetes japonicus) geschätzt, deren Hauptfangzeit im Winter und Frühjahr ist. Ihr Verzehr am Neujahrstag soll Glück und Wohlergehen im ganzen Jahr bringen. Ihr sind lokale Feste wie das Uljin Snow Crab Festival und das Yeongdeok Snow Crab Festival gewidmet.[112] In der koreanischen Kunst sind vor allem die Tuschezeichnungen von Kim Hong-do und Kim Hanyǒng,[113] in der Gegenwartsmalerei werden die Krabbendarstellungen von Yi Chungsǒp geschätzt.[114]
In der präkolumbischen Kultur werden in Mittelamerika die Mundwerkzeuge der Krabben, in der Amazonas-Region die Rückenzeichnung von Krabben mit der Vagina dentata assoziiert. Der Mythos der „gezahnten Vagina“ sollte junge Männer vor den Gefahren ausschweifender Sexualität warnen. Einer der Hauptgötter oder Helden der Moche-Kultur nimmt im Kampf Krabbenform an. Die Inka sehen die Krabbe als Verschlinger und assoziieren sie mit dem abnehmenden Mond.[109] In der Cotzumalhuapa-Kultur repräsentiert die Krabbe paxil, die weibliche Kraft der Geburt und Regeneration.[115] In den Mythen der nordamerikanischen Kwakwaka'wakw wird eine übernatürliche Krabbe mit der Kriegerin Tuxw'd in Verbindung gebracht.[116]
Heraldik

Wie Krebse werden auch Krabben gelegentlich als Wappentier in der Heraldik verwendet. So zieren Krabben das Wappen der französischen Gemeinden Audresselles, Guilvinec, Montsinéry-Tonnegrande und Senneville-sur-Fécamp, der italienischen Stadt Bivona, des niederländischen Ortes Dirksland, der kolumbianischen Stadt Tolú und der chilenischen Kommune Porvenir. Auch die Familienwappen des französischen Generals Bertrand Clausel sowie der Erzbischöfe Anthony John Ireland und Salvatore Joseph Cordileone zeigen Krabbendarstellungen.
Die Flagge der Union der Völker Kameruns trägt zentral ein Krabbensymbol auf rotem Grund. Diese war mit der Unabhängigkeit 1957 auch als neue Staatsflagge Kameruns in Erwägung gezogen worden.[117]
-
.svg.png) Wappen von Audresselles
Wappen von Audresselles -
 Wappen des niederländischen Ortes Dirksland
Wappen des niederländischen Ortes Dirksland -
 Wappen der italienischen Stadt Bivona
Wappen der italienischen Stadt Bivona
Moderne Rezeption

Gerade in der modernen Rezeption kommen vermeintlich generische Krabben vor, die jedoch keine Krabben im eigentlichen Sinne zeigen. Häufig handelt es sich dabei um Darstellungen der zu den Mittelkrebsen (Anomura) gehörenden Königskrabben oder Einsiedlerkrebse (englisch hermit crabs) mit krabbenähnlichem Aussehen. Beispiele hierfür sind etwa der reizbare und nervöse Hofmusikant „Sebastian“ in Disneys Arielle, die Meerjungfrau (1989), bei dem es sich um einen Einsiedlerkrebs handelt. In der populären Kultur ändert sich das Bild der Krabbe und sie erhält mehr positive Eigenschaften, vor allem Loyalität. Wie in der antiken Mythologie sind sie hartnäckig, aber in der Regel Nebenfiguren.[108]
In der US-amerikanischen Zeichentrickserie SpongeBob Schwammkopf (ab 1999) ist Eugene H. Krabs alias Mr. Krabs eine der Hauptfiguren und wird auch in Merchandise-Artikeln vermarktet. Die rote Krabbe ist vor allem für ihre Gier nach Geld bekannt. Sie betreibt das Schnellrestaurant „Die krosse Krabbe“ (Krusty Krab) und ist im Besitz der Rezeptur für den Krabbenburger, welche ihm sein Gegenspieler Plankton immer wieder stehlen möchte. In Disneys Findet Nemo (2003) treten Krabben als Nebenfiguren auf. In der Science-Fiction-Zeichentrickserie Futurama (1999) tritt mit Dr. John Zoidberg ein krabbenähnlicher Außerirdischer auf, der inkompetent, alles verschlingend und offensichtlich stinkend dargestellt wird. Im Animationsfilm Angespült – Ein Krabbenteuer werden die Hauptfiguren, die Krabben Armen und Ramona, von einem Sturm abgetrieben und begeben sich auf eine abenteuerliche Suche zurück nach Hause. Die Krabben sind hier sympathisch dargestellt.[118]
In James A. Micheners Roman Die Bucht (Originaltitel Chesapeake) aus dem Jahr 1978 wird das Leben der Blaukrabbe „Jimmy“ bildgewaltig dargestellt. Sie stirbt durch industrielle Giftstoffe, die eine Flutwelle in die Chesapeake Bay spült, auch einige Menschen sterben am Verzehr vergifteter Krabben.[108]
In einigen Horrorfilmen, meistens B-Movies, sind Krabben ein Motiv. Im Klassiker Attack of the Crab Monsters (deutscher Titel Angriff der Krebsmonster, 1957) sind Krabben durch radioaktive Strahlung von Atombombentests zu riesigen Monstern mutiert und jagen ein zur Untersuchung der Strahlung entsendetes Team von Wissenschaftlern. Sie ernähren sich nicht nur von den Menschen, sondern nehmen durch Verspeisen ihrer Gehirne auch die Intelligenz dieser an und erwerben die Fähigkeit telepathisch mit ihnen zu kommunizieren.[108] Im Trash-Horrorfilm Queen Crab – Die Killerkrabbe (2017) befreit ein Mädchen eine Krabbe und füttert diese mit gentechnisch behandelter Nahrung, wodurch sie sich in eine gigantische Killerkrabbe verwandelt, die ein Dorf terrorisiert.[119]
In einigen Mok-Bang, einem koreanischen Internetvideo-Phänomen bei dem es um den Verzehr riesiger Essensmengen geht, werden auch Krabben genutzt. Ein japanischer Mok-Bang-Poster namens Kaneko flog extra nach Tasmanien, um die größte erhältliche Tasmanische Riesenkrabbe zu essen, scheiterte jedoch.[86] Auch in den Aberglauben haben Krabben Eingang gefunden. So soll eine am Strand gesichtete Krabbe auf einen Streit, wenn ihr Panzer dick ist auf einen kalten Winter hindeuten. Werden Krabben und Hummer gesehen, gibt es keinen Frost mehr. Bei Neumond gefangene, gebrannte und dann zermahlene Krabben sollen Hydrophobie heilen.[120]
Forschungsgeschichte


Bereits in der Antike schrieb der griechische Universalgelehrte Aristoteles, dass die Zahl der Krabbenarten vermutlich unermesslich ist.[121] Der Beginn der wissenschaftlichen Erforschung der Krabben ist mit Carl von Linné verbunden. In seinem Systema Naturae ordnete er die Gattung Cancer in die Insekten und unterteilte sie in die Brachyiuri (Thorace laeve lateribus integerrimo) und Macrouri mit insgesamt elf Gruppen. Allerdings diente die Gattung Cancer damals als Sammelbecken für nahezu alle Krebstiere und sogar einige andere wasserlebende Gliederfüßer und der Begriff Brachyiuri ist nicht im Sinne der heutigen Teilordnung Brachyura zu verstehen.[122] 1790 unterteilte der deutsche Naturforscher Johann Friedrich Wilhelm Herbst in seiner Versuch einer Naturgeschichte der Krabben und Krebse die Krabben nach der Form des Cephalothorax und lieferte eine Reihe wissenschaftlicher Artbeschreibungen.[123] Der französische Zoologe Jean-Baptiste de Lamarck erkannte 1801, dass die Krebstiere als eigene Klasse außerhalb der Insekten angesiedelt werden sollten. 1802 untergliederte Pierre André Latreille Krebstiere zunächst in zwei Tribus (der Begriff ‚Tribus‘ war zu dieser Zeit eine Bezeichnung für höhere Taxa und entspricht nicht der der heutigen Verwendung), 1817 in sieben Sektionen auf der Grundlage der Körperform und der Anordnung der Beine. Daher ist die Autorenschaft für die Brachyura eher Latreille als Linné zuzuschreiben. Ein Wendepunkt in der systematischen Erforschung waren die Arbeiten Henri Milne-Edwards'. In seinem Werk Histoire naturelle des Crustacés (1834, 1837 und 1840) stellte er eine Klassifikation anhand morphologischer Beziehungen auf, die dank seines außerordentlichen Wissens zur Krabbenanatomie auf einer großen Anzahl von Merkmalen beruhte. Milne-Edwards beschrieb auch die unterschiedliche Position der Geschlechtsöffnungen. In Fortsetzung dieser Arbeiten schlug Wilhem de Haan zwischen 1833 und 1849 eine Reihe weiterer höherer Taxa vor.[122] Weitere wichtiger Vertreter der systematischen Erforschung in der ersten Hälfte des 19. Jahrhunderts waren William Sharp Macleay, James Dwight Dana und George Samouelle.
Einen anderen Ansatz verfolgte Ernst Nauck, der 1880 anhand der Ausbildung des Vorderdarms und der Magenmühle von 70 Krabbenarten die Brachyura in Heterodontea und Cyclodontea untergliederte. Dieser Ansatz konnte sich aber nicht durchsetzen. Johan Erik Vesti Boas unternahm den Versuch die Zehnfußkrebse neu zu ordnen. Er gliederte sie 1880 in die Natantia und Reptantia und stellte die Brachyuren als eine von 10 Triben zu den Reptantia. Als Untergruppe etablierte er primitive, Dromia-artige Krabben (Dromiacea) und ordnete die übrigen zu den „echten Krabben“ (Brachyura genuina). Ende des 19. Jahrhunderts trugen die Arbeiten Arnold Edward Ortmanns maßgeblich zur Erweiterung des Kenntnisstandes bei. Er erkannte zwei neue übergeordnete Gruppen (Majoidea und Cancroidea) und etablierte weitere Überfamilien. Der französische Zoologe Eugène Louis Bouvier nutzte die Lage der Vulva als Klassifikationsmerkmal und unterschied 1897 Podotremata und Sternitremata (Eubrachyura). Diesen wesentlichen Unterschied hatte bereits Henri Milne-Edwards erkannt, aber diese Gruppen nicht explizit benannt. Basierend auf den Arbeiten Boas' und Ortmanns schuf Lancelot Alexander Borradaile (1903, 1907) eine erste phylogenetische Systematik, die für die folgenden 60 Jahre allgemein anerkannt war. Er schlug drei Subtriben (Dromiacea, Brachygnatha, Oxystomata) und vier Überfamilien (Dromiidea, Homolidea, Brachyrhyncha und Oxyrhyncha) vor. Borradaile prägte auch den Begriff Carzinisierung für evolutionäre Vorgänge, die zur Ausprägung der typischen Krabbenform führen. Keppel Harcourt Barnard erweiterte Borradailes Klassifikation um die von Bourne (1922) vorgeschlagene Subtribus Gymnopleura für die Raninidae.[122] Ab Ende des 19. Jahrhunderts beschrieb Mary Jane Rathburn 1147 neue Arten und 64 neue Gattungen und verfasste vier Monografien über Krabben. Ursprünglich war sie nur eine Schreibkraft an der Smithsonian Institution, durch ihre akribische Arbeit arbeitete sie sich jedoch bis zur Assistenz-Kuratorin hoch, obwohl sie lediglich einen High-School-Abschluss und nie eine Hochschule besucht hatte. In den 1920er Jahren führte Isabella Gordon, erste weibliche Kuratorium am Londoner Naturkundemuseum und auch ‚Grand Dame der Karzinologie‘ bezeichnet, zahlreiche Studien zur Systematik der Zehnfußkrebse und zur Morphologie der Geschlechtsorgane primitiver Krabben durch.[121] Heinrich Balss führte 1957 mit den Hapalocarcinoidea (heute Gallkrabben) Borradailes Systematik eine weitere Hauptgruppe hinzu. In den 1960er und 1970er Jahren bestätigten Isabella Gordon und Richard G. Hartnoll die prinzipielle Unterteilung Bouviers in Podotremata und Eubrachyura. Seitdem wurden zahlreiche weitere Merkmale zur Abklärung der Monophylie herangezogen. Ab Ende der 1970er Jahre lieferte Danièle Guinot zahlreiche Arbeiten zur Klassifikation der Krabben, die Borradailes Systematik grundlegend modernisierten. Unter anderem führte sie die Unterteilung der Eubrachyura in Hetero- und Thoracotremata ein.[122] 1977 und 1980 wurden die ersten Allozym-Analysen zum Nachweis des genetischen Polymorphismus bei Krabben durchgeführt.[124]
In den 2000er Jahren führten die Arbeitsgruppen um den Kalifornier Peter Castro, den Kroaten Zdravko Števčić, den Australier Shane T. Ahyong und den Singaporer Peter Kee Lin Ng zahlreiche Studien durch und etablierten neue Überfamilien, Familien, Gattungen und Arten. In der Erforschung der fossilen Krabben und ihrer Klassifizierung waren vor allem Rodney M. Feldmann und Carrie E. Schweitzer maßgeblich aktiv. Mit der Weiterentwicklung der Polymerase-Kettenreaktion-Technik stieg ab den 2000er Jahren auch die Anzahl Studien mit DNA-Analysen zu phylogenetischen Fragestellungen und zur Artabgrenzung bei Krabben stark an.[124] Untersuchungen zur molekularen Uhr durch Ling Ming Tsang und Mitarbeiter konnten 2014 die Hypothese erhärten, dass Krabben vor etwa 180 mya im Jura entstanden, was sich mit Fossilfunden deckt.[122] Wolfe et al. datierten 2019 die Entstehung etwas früher, die erste Aufspaltung begann nach ihren Untersuchungen im späten Trias vor gut 200 mya.[75]
Einzelnachweise
- ↑ a b c Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: P. Castro, P. J. F. Guinot Davie, F. R. Schram, J. C. von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 11–13.
- ↑ J. S. Lucas, P. J. F. Davie: Hymenosomatid crabs of Queensland estuaries and tidal mud flats, including descriptions of four new species of Elamenopsis A. Milne-Edwards and a new species of Amarinus Lucas. In: Memoirs of the Queensland Museum Band 20, Nummer 3, 1982, S. 401–419.
- ↑ a b c Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 19−23.
- ↑ a b c d Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 13−18.
- ↑ a b c d e f Gary C.B. Poore, Shane T. Ahyong: Brachyura. In: Marine Decapod Crustacea: A Guide to Families and Genera of the World. Csiro Publishing, 2023, ISBN 978-1-4863-1180-4, S. 421–422.
- ↑ Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 23−26.
- ↑ a b c Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 42–45.
- ↑ a b c Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 41–42.
- ↑ a b Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 64–65.
- ↑ a b c d Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 65–69.
- ↑ Gary C. B. Poore, Shane T. Ahyong: Brachyura. In: Marine Decapod Crustacea: A Guide to Families and Genera of the World. Csiro Publishing, 2023, ISBN 978-1-4863-1180-4, S. 536.
- ↑ a b c Colin L. McLay, Carola Becker: Reproduction in Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 185–190.
- ↑ Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 99–102.
- ↑ Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 102–112.
- ↑ a b Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 112–117.
- ↑ Gerhard Heldmaier: Vegetative Physiologie. Springer, 2013, ISBN 978-3-642-18950-0, S. 176.
- ↑ a b Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 117–121.
- ↑ a b c Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Anatomy and Functional Morphology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 121–123.
- ↑ S. Y. Lee: Ecology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 499.
- ↑ Sven Thatje, Kathryn E. Smith, James B. McClintock, Richard B. Aronson: From deep to shallow seas: Antarctic king crab on the move. In: Ecology. Band 101, Nr. 11, 2020, S. e03125, doi:10.1002/ecy.3125.
- ↑ a b Da Pan, Yunlong Sun, Boyang Shi, Ruxiao Wang, Peter K. L. Ng, Danièle Guinot, Neil Cumberlidge, Hongying Sun: Phylogenomic analysis of brachyuran crabs using transcriptome data reveals possible sources of conflicting phylogenetic relationships within the group. In: Molecular Phylogenetics and Evolution. Band 201, 2024, S. 108201, doi:10.1016/j.ympev.2024.108201.
- ↑ a b Sebastian Klaus: Süßwasserkrabben. Biogeographie und Stammesgeschichte. In: SENCKENBERG – natur • forschung • museum Band 141 Nummer 1 / 2, 2011, S. 24–33.
- ↑ a b c d e f Joanna M. Wolfe, Lauren Ballou, Javier Luque, Victoria M. Watson-Zink, Shane T. Ahyong, Joëlle Barido-Sottani, Tin-Yam Chan, Ka Hou Chu, Keith A Crandall, Savel R. Daniels, Darryl L. Felder, Harrison Mancke, Joel W Martin, Peter K. L. Ng, Javier Ortega-Hernández, Emma Palacios Theil, N. Dean Pentcheff, Rafael Robles, Brent P Thoma, Ling Ming Tsang, Regina Wetzer, Amanda M. Windsor, Heather D. Bracken-Grissom: Convergent Adaptation of True Crabs (Decapoda: Brachyura) to a Gradient of Terrestrial Environments. In: Systematic Biology 73 (2), März 2024; S. 247–262, doi:10.1093/sysbio/syad066.
- ↑ a b Victoria M. Watson-Zink: Making the grade: Physiological adaptations to terrestrial environments in decapod crabs. In: Arthropod Structure & Development 64, September 2021, 101089, doi:10.1016/j.asd.2021.101089.
- ↑ S. Y. Lee: Ecology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 471–472.
- ↑ a b S. Y. Lee: Ecology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 513.
- ↑ S. Y. Lee: Ecology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 500.
- ↑ S. Y. Lee: Ecology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 512.
- ↑ S. Y. Lee: Ecology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 504.
- ↑ S. Y. Lee: Ecology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 506.
- ↑ a b c S. Y. Lee: Ecology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 508.
- ↑ S. Y. Lee: Ecology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 511.
- ↑ R. G. Hartnoll: Mating in the Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 161–174.
- ↑ R. G. Hartnoll: Mating in the Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 174–181.
- ↑ Colin L. McLay, Carola Becker: Reproduction in Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 220–190.
- ↑ a b c d Paul F. Clark, Joé A. Cuesta: Larval systematics of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 981–1048.
- ↑ a b Colin L. McLay: Moulting and growth in Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 245–246.
- ↑ a b c d Klaus Anger: Pattern of larval development of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 318–334.
- ↑ Florian Braig, Carolin Haug, Joachim T. Haug: Morphological diversity in true and false crabs reveals the plesiomorphy of the megalopa phase. In: Scientific Reports. Band 14, Nr. 1, 2024, S. 8682, doi:10.1038/s41598-024-58780-7, PMID 38622222 (nature.com).
- ↑ Colin L. McLay: Moulting and growth in Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 244–249.
- ↑ S. Y. Lee: Ecology of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 515.
- ↑ a b c Peter Castro: Symbiotic Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 543–545.
- ↑ Henrique Bravo, Charlotte R. Dromard, Marcel T. J. van der Meer, Anna Schleimer, Sancia E. T. van der Meij: Dining on corals: stable isotope evidence for close trophic connection between gall crabs (Cryptochiridae) and their stony coral hosts. In: Symbiosis. 2024, Band 92, Nummer 1, S. 51–62 doi:10.1007/s13199-023-00968-y.
- ↑ Peter Castro: Symbiotic Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 559.
- ↑ Peter Castro: Symbiotic Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 560.
- ↑ Peter Castro: Symbiotic Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 562.
- ↑ Peter Castro: Symbiotic Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 549.
- ↑ Peter Castro: Symbiotic Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 552.
- ↑ a b c Jeffrey D. Shields, Jason D. Williams, Christopher B. Boyko: Parasites and diseases of Brachyura. In: P. Castro, P. J. F. Guinot Davie, F. R. Schram, J. C. von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 641–659.
- ↑ a b Jeffrey D. Shields, Jason D. Williams, Christopher B. Boyko: Parasites and diseases of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 659–671.
- ↑ a b Jeffrey D. Shields, Jason D. Williams, Christopher B. Boyko: Parasites and diseases of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 659–682.
- ↑ Albert K. Sparks, Jolly Hibbits: Black mat syndrome, an invasive mycotic disease of the tanner crab, Chionoecetes bairdi. In: Journal of Invertebrate Pathology. Band 34, Nr. 2, 1979, S. 184–191, doi:10.1016/0022-2011(79)90100-9 (elsevier.com).
- ↑ a b c Jeffrey D. Shields, Jason D. Williams, Christopher B. Boyko: Parasites and diseases of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 682–695.
- ↑ Paul A. Haefner, P. J. Spacher: Gill Meristics and Branchial Infestation of Ovalipes Stephensoni (Crustacea, Brachyura) by Synophrya Hypertrophica (Ciliata, Apostomida). In: Journal of Crustacean Biology. 1985, Band 5, Nummer 2, S. 273–280 doi:10.2307/1547874.
- ↑ Ade Wahyul Fajri Alimin, Nor Asma Husna Yusoff, Ince Ayu Khairana Kadriah, Hilal Anshary, Farizan Abdullah, Nurhidayah Jabir, Endang Susianingsih, Marina Hassan: Parasitic dinoflagellate Hematodinium in marine decapod crustaceans: a review on current knowledge and future perspectives. In: Parasitology Research. 2023, Band 123, Nummer 1 doi:10.1007/s00436-023-08067-z.
- ↑ a b c Jeffrey D. Shields, Jason D. Williams, Christopher B. Boyko: Parasites and diseases of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 695–701.
- ↑ Jeffrey D. Shields, Jason D. Williams, Christopher B. Boyko: Parasites and diseases of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 701–702.
- ↑ Jeffrey D. Shields, Jason D. Williams, Christopher B. Boyko: Parasites and diseases of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 703.
- ↑ Jeffrey D. Shields, Jason D. Williams, Christopher B. Boyko: Parasites and diseases of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 704–705.
- ↑ Jeffrey D. Shields, Jason D. Williams, Christopher B. Boyko: Parasites and diseases of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 705–708.
- ↑ Jeffrey D. Shields, Jason D. Williams, Christopher B. Boyko: Parasites and diseases of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 708–711.
- ↑ a b c d Jeffrey D. Shields, Jason D. Williams, Christopher B. Boyko: Parasites and diseases of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 711–722.
- ↑ Christopher B. Boyko, Sancia E. T. van der Meij: A trifecta of Swiftian symbioses: stony corals, gallcrabs and their parasites (Scleractinia; Brachyura: Cryptochiridae; Isopoda: Epicaridea and Cirripedia: Rhizocephala). In: Zoological Journal of the Linnean Society, Band 20, 2018, S. 1–26.
- ↑ a b Annette Brockerhoff, Colin McLay (2011): Human-mediated spread of alien crabs. In: Bella S. Galil, Paul F. Clark und James T. Carlton (Hrsg.): In the Wrong Place - Alien Marine Crustaceans: Distribution, Biology and Impacts. Springer Dordrecht, 2011, S. 27f. doi:10.1007/978-94-007-0591-3_2.
- ↑ Colin McLay: Invasive Brachyura. In: P. Castro, P. J. F. Guinot Davie, F. R. Schram, J. C. von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 821–846; hier 821–822.
- ↑ Colin McLay: Invasive Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 821–846; hier 838.
- ↑ S. Lowe, M. Browne, S. Boudjelas, M. De Poorter: 100 of the World’s Worst Invasive Alien Species. A selection from the Global Invasive Species Database. Herausgegeben von The Invasive Species Specialist Group (ISSG) der World Conservation Union (IUCN). Erstmalig erschienen als Spezialbeilage in Aliens 12, Dezember 2000. Update und Reprint: November 2004. Digitalisat: PDF
- ↑ Matt G. Bentley: The Global Spread of the Chinese Mitten Crab Eriocheir sinensis. In: Bella S. Galil, Paul F. Clark und James T. Carlton (Hrsg.): In the Wrong Place - Alien Marine Crustaceans: Distribution, Biology and Impacts. Springer Dordrecht, 2011, S. 107–127 doi:10.1007/10.1007/978-94-007-0591-3_3.
- ↑ a b Annette Brockerhoff, Colin McLay (2011): Human-mediated spread of alien crabs. In: Bella S. Galil, Paul F. Clark und James T. Carlton (Hrsg.): In the Wrong Place - Alien Marine Crustaceans: Distribution, Biology and Impacts. Springer Dordrecht, 2011, S. 55f. doi:10.1007/978-94-007-0591-3_2.
- ↑ Chiara Sabelli: What scientists know about the blue crab invasion. In: nature.com, 1. September 2023; abgerufen am 11. Mai 2025.
- ↑ Blaukrabbe auf Usedom entdeckt: Spaziergänger macht „Sensationsfund“ in Ahlbeck. Mitteldeutsche Zeitung (nach dpa), 3. Mai 2023; abgerufen am 11. Mai 2025.
- ↑ a b c d e f g h Colin McLay: Invasive Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 821–846; hier 835–836.
- ↑ Peter K. L. Ng, Shane T. Ahyong: Discovery of a new genus and new species of Indo-West Pacific pilumnoidid crab from a semisubmersible oil platform (Crustacea: Brachyura: Pseudozioidea). Zootaxa, 1. Januar 2013, 3682; S. 513–520, doi:10.11646/zootaxa.3682.4.2
- ↑ Colin McLay: Invasive Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 821–846; hier 837.
- ↑ a b c d e f Joanna M. Wolfe, Jesse W. Breinholt, Keith A. Crandall, Alan R. Lemmon, Emily Moriarty Lemmon, Laura E. Timm, Mark E. Siddall, Heather D. Bracken-Grissom: A phylogenomic framework, evolutionary timeline and genomic resources for comparative studies of decapod crustaceans. In: Procedings of the Royal Society B - Biological Sciences 286 (190124), April 2019, doi:10.1098/rspb.2019.0079.
- ↑ a b c Ling Ming Tsang, Christoph D. Schubart, Shane T. Ahyong, Joelle C. Y. Lai, Eugene Y.C. Au, Tin‐Yam Chan, Peter K. L. Ng, Ka Hou Chu: Evolutionary History of True Crabs (Crustacea: Decapoda: Brachyura) and the Origin of Freshwater Crabs. In: Molecular Biology and Evolution. 2014, Band 31, Nummer 5, S. 1173–1187 doi:10.1093/molbev/msu068.
- ↑ J. Luque, R. M. Feldmann, O. Vernygora, C. E. Schweitzer, C. B. Cameron, K. A. Kerr, F. J. Vega, A. Duque, M. Strange, A. R. Palmer, C. Jaramillo: Exceptional preservation of mid-Cretaceous marine arthropods and the evolution of novel forms via heterochrony. Science Advantages 5 (4), April 2019, doi:10.1126/sciadv.aav387.
- ↑ John W. M. Jagt et al.: Fossil Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 847–866.
- ↑ Keith A. Crandall, Megan L. Porter, Marcos Pérez-Losada: Crabs, shrimps, and lobsters (Decapoda). In: S. Blair Hedges, Sudhir Kumar: The Timetree of Life. Oxford University Press, 23. April 2009, ISBN 978-0-19-953503-3, S. 293–297. (Volltext)
- ↑ Gary C. B. Poore, Shane T. Ahyong: Brachyura. In: Marine Decapod Crustacea: A Guide to Families and Genera of the World. Csiro Publishing, Clayton South 2023, ISBN 978-1-4863-1180-4, S. 263–264.
- ↑ Gerhard Scholtz, Stefan Richter: Phylogenetic systematics of the reptantian Decapoda (Crustacea, Malacostraca). In: Zoological Journal of the Linnean Society. Band 113, Nr. 3, 1995, ISSN 0024-4082, S. 289–328, doi:10.1006/zjls.1995.0011 (sciencedirect.com).
- ↑ Florian Braig, Carolin Haug, Joachim T. Haug: Morphological diversity in true and false crabs reveals the plesiomorphy of the megalopa phase. In: Scientific Reports. Band 14, Nr. 1, 2024, ISSN 2045-2322, S. 8682, doi:10.1038/s41598-024-58780-7, PMID 38622222 (nature.com).
- ↑ Meiura. marinespecies.org/, abgerufen am 16. September 2025 (englisch).
- ↑ Sammy De Grave, N. Dean Pentcheff, Shane T. Ahyong, Tin-Yam Chan, Keith A. Crandall, Peter C. Dworschak, Darryl L. Felder, Rodney M. Feldmann, Charles H. J. M. Fransen, Laura Y. D. Goulding, Rafael Lemaitre, Martyn E. Y. Low, Joel W. Martin, Peter K. L. Ng, Carrie E. Schweitzer, S. H. Tan, Dale Tshudy, Regina Wetzer: A classification of living and fossil genera of decapod crustaceans. Raffles Bulletin of Zoology, Supplement No. 21, 2009: 1–286. (Vollext)
- ↑ Gary C. B. Poore, Shane T. Ahyong: Brachyura. In: Marine Decapod Crustacea: A Guide to Families and Genera of the World. Csiro Publishing, Clayton South 2023, ISBN 978-1-4863-1180-4, S. 421–879.
- ↑ a b c d e f g h i Cynthia Chris: Crab. Kapitel 4: A Deadly Catch?. Reaktion Books, 2021, ISBN 978-1-78914-370-6, S. 101–125.
- ↑ a b c Y. H. Hui, Isabel Guerrero Legarretta, Miang Hoong Lim, K.D. Murrell, Wai-Kit Nip: Handbook of Frozen Foods. CRC Press, 2004, ISBN 978-0-203-02200-9, S. 310–311.
- ↑ H.-D. Belitz, Werner Grosch, Peter Schieberle: Food Chemistry. 3. Auflage. Springer Science & Business Media, 2004, ISBN 978-3-540-40817-8, S. 640.
- ↑ a b Alexandria M. Walus, Eric V. C. Schneider, Erin N. Parker, Candice Brittain, Iain J. McGaw, Daniel Hayes, Amber K. Peters, Travis E. Van Leeuwen: A comparison of claw removal methods on the survival and claw regeneration of stone crab (Menippe mercenaria). In: Journal of Experimental Marine Biology and Ecology. 2023, Band 563, S. 151895 doi:10.1016/j.jembe.2023.151895.
- ↑ a b Colin Shelley, Alessandro Lovatelli: Mud crab aquaculture, A practical manual. FAO Fisheries and Aquacultur Technical Paper Nr. 576. Rom 2011, ISBN 978-92-5-106990-5 (online)
- ↑ Jeffrey D. Shields, Jason D. Williams, Christopher B. Boyko: Parasites and diseases of Brachyura. In: P. Castro, P. J. F. Guinot Davie, F. R. Schram, J. C. von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 651.
- ↑ Diogo Barbalho Hungria, Camila Prestes dos Santos Tavares, Leandro Ângelo Pereira, Ubiratã de Assis Teixeira da Silva, Antonio Ostrensky: Global status of production and commercialization of soft-shell crabs. In: Aquaculture International. Band 25, Nr. 6, 2017, S. 2213–2226, doi:10.1007/s10499-017-0183-5.
- ↑ a b Xiaodie Yan, Cong Zhang: The connotation of Chinese crab culture: a comprehensive review from the perspectives of literature, art, and diet. In: Frontiers in Marine Science. Band 12, 2025, doi:10.3389/fmars.2025.1556758 (frontiersin.org).
- ↑ Martin Smollich: Der Nährstoff-Kompass: Was ist essenziell, was verzichtbar und was gefährlich. Gräfe und Unzer, 2025, ISBN 978-3-8338-9580-7.
- ↑ Peter J. F. Davie: Crabs: A Global Natural History. Princeton University Press, 2021, ISBN 978-0-691-23013-9.
- ↑ Yiu-Chung Wong, Richard J. Lewis, Sr.: Analysis of Food Toxins and Toxicants. John Wiley & Sons, 2017, ISBN 978-1-118-99271-5, S. 660.
- ↑ a b Sharon L. Seelman et al.: An Outbreak Investigation of Vibrio parahaemolyticus Infections in the United States Linked to Crabmeat Imported from Venezuela: 2018. In: Foodborne Pathogens and Disease. Band 20, Nr. 4, 2023, S. 123–131, doi:10.1089/fpd.2022.0078, PMID 37015074 (liebertpub.com).
- ↑ P. Matulkova, M. Gobin, J. Taylor, F. Oshin, K. O'connor, I. Oliver: Crab meat: a novel vehicle for E. coli O157 identified in an outbreak in South West England, August 2011. In: Epidemiology & Infection. Band 141, Nr. 10, 2013, S. 2043–2050, doi:10.1017/S0950268812002816, PMID 23218436 (cambridge.org).
- ↑ About Paragonimiasis. CDC. Abgerufen am 5. September 2025.
- ↑ Rote Liste 1996. Abgerufen am 3. September 2025.
- ↑ Conservation successes overshadowed by more species declines – IUCN Red List update IUCN Pressemitteilung vom 23. Juni 2015. Abgerufen am 3. September 2025.
- ↑ iucnredlist.org.. Abgerufen am 3. September 2025.
- ↑ Neil Cumberlidge, Peter K. L. Ng, Darren C. J. Yeo, Célio Magalhães, Martha R. Campos, Fernando Álvarez, Tohru Naruse, Savel R. Daniels, Lara J. Esser, F. Y. K. Attipoe, France-Lyse Clotilde-Ba, W.R.T. Darwall, Anna McIvor, Jonathan Baillie, Ben Collen, Mala Ram: Freshwater crabs and the biodiversity crisis: Importance, threats, status, and conservation challenges. In: Biological Conservation. 2009, Band 142, Nummer 8, S. 1665–1673 doi:10.1016/j.biocon.2009.02.038.
- ↑ Masoud Yousefi, Reza Naderloo, Alireza Keikhosravi: Freshwater crabs of the Near East: Increased extinction risk from climate change and underrepresented within protected areas. In: Global Ecology and Conservation. 2022, Band 38, S. e02266 doi:10.1016/j.gecco.2022.e02266.
- ↑ R. C. Chick: South Australian Giant Crab (Pseudocarcinus gigas) Fishery Status Report 2011/12. 2013. SARDI Publikation Nr. F2011/0003332-3 (PDF). Abgerufen am 3. September 2025.
- ↑ Norwegen: Fangquote für Schneekrabbe steigt 2023 um 16 %. In: Fischmagazin vom 20. Dezember 2022. (online. Abgerufen am 3. September 2025)
- ↑ a b c d e f g h i j k l m Guy Charmantier: Crustaceans in art. In: C. von Vaupel Klein: Treatise on Zoology - Anatomy, Taxonomy, Biology. The Crustacea, Volume 4 Part B. Brill, 2014, ISBN 978-90-04-26493-9, S. 139–187. doi:10.1163/9789004264939_005.
- ↑ a b c d e f Cynthia Chris: Crab. Kapitel 3: Are Crabs Crabby?. Reaktion Books, 2021, ISBN 978-1-78914-370-6, S. 60–78.
- ↑ a b c d Hope B. Werness: Continuum Encyclopedia of Animal Symbolism in World Art. A&C Black, 2006, ISBN 978-0-8264-1913-2, S. 112–113.
- ↑ Henry-Michel Cauchie, Théodore Monod, Lucien Laubier: Crustaceans in Mythology, Art, History, and Popular Culture. In: .C. von Vaupel Klein: Treatise on Zoology - Anatomy, Taxonomy, Biology. The Crustacea, Volume 4 Part B. Brill, 2014, ISBN 978-90-04-26493-9, S. 127–129. doi:10.1163/9789004264939_004.
- ↑ Joel W. Martin: The Samurai Crab. In: Terra Band 31, Nummer 4, 1993, S. 30–34.
- ↑ Korea’s snow crab capital a winter tourist draw with festival celebrating the crustacean. The Korea Times vom 16. Februar 2025. Abgerufen am 9. September 2025.
- ↑ Francis Mullany: Symbolism in Korean Ink Brush Painting. BRILL, 2022, ISBN 978-90-04-21361-6, S. 115–116.
- ↑ Keith Pratt, Richard Rutt: Korea: A Historical and Cultural Dictionary. Routledge, 2013, ISBN 978-1-136-79393-6, S. 129.
- ↑ Fernando A. Moreira: The crab as cosmic yux: a symbol of power and creation in Cotzumalhuapa. In: Ancient Mesoamerica. 2019, Band 31, Nummer 2, S. 308–318 doi:10.1017/S0956536118000433.
- ↑ Cheryl Shearar: Understanding Northwest Coast Art: A Guide to Crests, Beings and Symbols. D & M Publishers, 2008, ISBN 978-1-926706-16-0, S. 32.
- ↑ Karl-Heinz Hesmer: Flaggen und Wappen der Welt. wissenmedia Verlag, 2008, ISBN 978-3-577-14537-4, S. 114.
- ↑ Angespült – ein Krabbenteuer. Abgerufen am 31. August 2025.
- ↑ Queen Crab - Die Killerkrabbe. filmdienst.de. Abgerufen am 31. August 2025.
- ↑ Cora Linn Daniels, C. M. Stevans: Encyclopaedia of Superstitions, Folklore, and the Occult Sciences of the World: Band 2. The Minerva Group, 2003, ISBN 978-1-4102-0915-3, S. 605.
- ↑ a b Cynthia Chris: Crab. Kapitel 2: Classifying Crabs. Reaktion Books, 2021, ISBN 978-1-78914-370-6, S. 28–54.
- ↑ a b c d e Peter J. F. Davie, Danièle Guinot, Peter K. L. Ng: Phylogeny of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 922–926.
- ↑ Johann Friedrich Wilhelm Herbst: Versuch einer Naturgeschichte der Krabben und Krebse: nebst einer systematischen Beschreibung ihrer verschiedenen Arten. Gottlieb August Lange, Berlin 1790.
- ↑ a b Ka Hou Chu, Christoph D. Schubart, Hsi-Te Shih, Ling Ming Tsang: Genetic diversity and evolution of Brachyura. In: Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, S. 775–777.
Literatur
- Peter Castro, Peter J. F. Davie, Danièle Guinot, Frederick R. Schram, J. Carel von Vaupel Klein (Hrsg.): The Crustacea. Band 2. Koninklijke Brill NV, Leiden 2015, ISBN 978-90-04-19083-2
- Gary C. B. Poore, Shane T. Ahyong: Brachyura. In: Marine Decapod Crustacea: A Guide to Families and Genera of the World. Csiro Publishing, Clayton South 2023, ISBN 978-1-4863-1180-4, S. 421–879.