Doebner-Reaktion
Die Doebner-Reaktion oder Doebner-Chinolinsynthese ist eine Namensreaktion der Organischen Chemie.[1] Sie wurde erstmals 1887 von Oskar Gustav Doebner (1850–1907) als Synthese von Säure-Derivaten des Chinolins beschrieben.[1][2] Im Gegensatz zur Synthese von Säure-Derivaten des Chinolins nach Pfitzinger erfolgt die Synthese nach Doebner ausgehend von Brenztraubensäure, einem Aldehyd und Anilin.[3][4]
Übersichtsreaktion
Entsprechend der verwendeten Edukte Brenztraubensäure und dem Aldehyd handelt es sich bei dem abschließenden Reaktionsprodukt um eine α,β-ungesättigte Carbonsäure (mit der grau markierten Struktur entspricht die α,β-ungesättigte Carbonsäure dem anschließend angeführten Reaktionsprodukt der Doebner-Reaktion):[4]
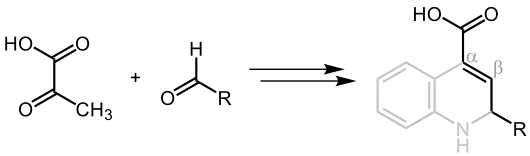
In Anbetracht der Durchführung Doebners mit Anilin, handelt es sich bei dem Produkt um ein Derivat des Chinolins, spezieller um eine Chinolin-4-carbonsäure:[4]

Reaktionsmechanismus
Der Reaktionsmechanismus ist nicht genau bekannt, hier werden zwei Vorschläge aufgeführt.[1] Eine Möglichkeit ist die zunächst vonstatten gehende Aldolkondensation, ausgehend von der Enol-Form der Brenztraubensäure (1) und dem Aldehyd, unter Bildung einer β,γ-ungesättigten α-Ketocarbonsäure (2).[1] Gefolgt von einer Michael-Addition mit Anilin bildet sich ein Anilin-Derivat (3). Nach der Cyclisierung am Benzolring und zwei Protonenverschiebungen entsteht unter Wasserabspaltung die Chinolin-4-carbonsäure (4):[1]

Ein alternativer Mechanismus beschreibt ausgehend vom Anilin und dem Aldehyd unter Wasserabspaltung die Bildung der Schiff'schen Base.[1] Die anschließende Reaktion mit der Enol-Form der Brenztraubensäure (1) führt zur Bildung des eben erwähnten Anilinderivats (3) und der Fortführung des bereits beschriebenen Reaktionsmechanismus:[1]

Konkurrenzreaktion
Der Literatur lässt sich entnehmen, dass die Doebner-Reaktion im Fall der Reaktion von 2-Chlor-5-aminopyridin versagt.[5] Die Cyclisierung würde in diesem Fall an der Aminogruppe anstelle des Benzolrings erfolgen und zu einem Derivat des Pyrrolidins führen.[5]
Atomökonomie
Die Doebner-Reaktion hat im Allgemeinen eine gute Atomökonomie.[6]
Siehe auch
Alternative Synthesen von Chinolinderivaten sind beispielsweise die Combes-Chinolinsynthese, die Conrad-Limpach-Chinolinsynthese und die Pfitzinger-Reaktion für die Synthese von Säure-Derivaten des Chinolins.[1][3]
Einzelnachweise
- ↑ a b c d e f g h Daniel Zerong Wang: Comprehensive Organic Name Reactions and Reagents. Band 1. John Wiley & Sons, Inc., John Wiley & Sons, Inc., Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 921–923, doi:10.1002/9780470638859.conrr197.
- ↑ Rudolf Pummerer: Doebner. In: Neue Deutsche Biographie. Band 4, Duncker & Humblot, Berlin 1959, ISBN 3-428-00185-0, S. 13–14.
- ↑ a b W. Pfitzinger: Chinolinderivate aus Isatinsäure. In: Journal für Praktische Chemie. Band 33, Nr. 1, 1886, S. 100, doi:10.1002/prac.18850330110.
- ↑ a b c Oscar Doebner: Ueber α-Alkylcinchoninsäuren und α-Alkylchinoline. In: Justus Liebigs Annalen der Chemie. Band 242, Nr. 3, 1887, S. 265–388, doi:10.1002/jlac.18872420302.
- ↑ a b Martin J. Weiss, Charles R. Hauser: Failure of the Doebner Reaction with 2-Chloro-5-aminopyridine. Synthesis of a Pyrrolidine Derivative. In: Journal of the American Chemical Society. Band 68, Nr. 4, 1946, S. 722–723, doi:10.1021/ja01208a513.
- ↑ John Andraos: Unification of Reaction Metrics for Green Chemistry II: Evaluation of Named Organic Reactions and Application to Reaction Discovery. In: Organic Process Research & Development. Band 9, Nr. 4, 1. Juli 2005, S. 404–431, doi:10.1021/op050014v.