Dithiatetraazaadamantantetroxid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
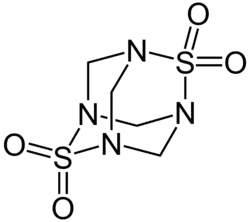
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dithiatetraazaadamantantetroxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H8N4O4S2 | |||||||||||||||
| Kurzbeschreibung |
geruch- und geschmackloser, weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 240,26 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Dithiatetraazaadamantantetroxid ist eine chemische Verbindung aus der Gruppe der Adamantane.
Dithiatetraazaadamantantetroxid wirkt als nichtkompetitiver GABAA-Rezeptor-Antagonist und ist ein starkes Krampfgift. Die Verbindung ist fünfmal toxischer als Strychnin.[3][4]
Geschichte
Die Verbindung wurde erstmals 1933 synthetisiert.[1] Während des Zweiten Weltkriegs wurde bei der Suche nach einer unentflammbaren Faser Material mit Sulfamid und Formaldehyd imprägniert, wobei die Arbeiter schwere Vergiftungserscheinungen erlitten. 1949 wurde von Gerhard Hecht und Hans Henecka das Dithiatetraazaadamantantetroxid als Verursacher ausgemacht und über die Synthese berichtet.[3] Im selben Jahr wurde die Verbindung von der Bayer AG als Rodentizid patentiert.[5] 1959 gelangte das Wissen über die Synthese von Dithiatetraazaadamantantetroxid und seine Anwendung als Rattengift in die Volksrepublik China.[6] Die Herstellung und Verwendung von TETS ist seit 1984 weltweit verboten.[1]
Gewinnung und Darstellung
Dithiatetraazaadamantantetroxid lässt sich durch Kondensation von Sulfamid mit Formaldehyd in salzsaurer Lösung darstellen.[4][3]
Verwendung
Dithiatetraazaadamantantetroxid wurde als Rodentizid verwendet.[7] Obwohl die Verbindung in der VR China seit 1984 verboten ist, kam es dort noch in den 2000er Jahren zu Massenvergiftungen.[7]
Weblinks
Einzelnachweise
- ↑ a b c d e f g Jiří Patocka, Tanos C. C. Franca, Qinghua Wu, Kamil Kuca: Tetramethylenedisulfotetramine: A Health Risk Compound and a Potential Chemical Warfare Agent. In: Toxics. Band 6, Nr. 3, 2018, S. 51, doi:10.3390/toxics6030051, PMID 30135374.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von [No public or meaningful name is available] im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 16. September 2017.
- ↑ a b c G. Hecht, H. Henecka: Über ein hochtoxisches Kondensationsprodukt von Sulfamid und Formaldehyd. In: Angewandte Chemie. Band 61, Nr. 9, September 1949, S. 365–366, doi:10.1002/ange.19490610905.
- ↑ a b Eugen Müller: Neuere Anschauungen der organischen Chemie: Organische Chemie für Fortgeschrittene. 2. Auflage. Springer, 1957, S. 57, doi:10.1007/978-3-642-87591-5.
- ↑ Patent US2650186: Rodenticidal compositions. Angemeldet am 10. Dezember 1949, veröffentlicht am 25. August 1953, Anmelder: Bayer AG, Erfinder: Gerhard Hecht, Hans Henecka, Marianne Meisenheimer.
- ↑ 莫若瑩,秦錫元.毒雀灭鼠药——四次甲基二碸四胺的合成.藥學通報,1959,7(8):395
- ↑ a b K. Scott Whitlow, Martin Belson, Fermin Barrueto, Lewis Nelson, Alden K. Henderson: Tetramethylenedisulfotetramine: old agent and new terror. In: Annals of Emergency Medicine. Band 45, Nr. 6, Juni 2005, S. 609–613, doi:10.1016/j.annemergmed.2004.09.009, PMID 15940093 (dead-planet.net [PDF]). PDF ( vom 3. September 2013 im Internet Archive)
