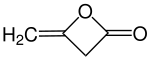
Diketen
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diketen | ||||||||||||||||||
| Andere Namen |
4-Methylenoxetan-2-on (IUPAC) | ||||||||||||||||||
| Summenformel | C4H4O2 | ||||||||||||||||||
| Kurzbeschreibung |
entzündliche, sehr reaktionsfähige, farblose Flüssigkeit mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 84,07 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,09 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
127 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
löslich unter Hydrolyse in Wasser[1] | ||||||||||||||||||
| Brechungsindex |
1,4379 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−233,1 kJ/mol[4] | ||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Diketen (nach IUPAC-Nomenklatur: 4-Methylenoxetan-2-on) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Lactone. Ein Ersatzstoff für Diketen ist das Diketen-Aceton-Addukt.
Gewinnung und Darstellung
Diketen wird technisch durch Dimerisierung von Keten bei nur leicht erhöhten Temperaturen von 35–40 °C in Rieseltürmen hergestellt.[5]
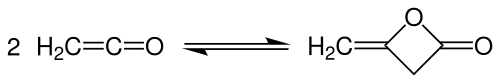
Bei dieser exothermen Reaktion (ΔHR= −189 kJ·mol−1) leitet man Keten einem Flüssigkeitsstrom von Diketen entgegen, wobei ein nahezu vollständiger Umsatz erreicht wird. Der Temperaturbereich muss genau eingehalten werden, da sonst das Diketen sofort wieder in Keten zerfällt. Das Abgas wird mit verdünnter Essigsäure gewaschen, um nicht-umgesetztes Keten zu entfernen. Die Reinigung und Aufarbeitung erfolgt durch Destillation.[5]
Eigenschaften
Diketen ist eine sehr reaktionsfähige, farblose Flüssigkeit, die durch Dimerisierung von Keten bei Raumtemperatur entsteht und zur spontanen Polymerisation neigt. Durch Erhitzen lässt es sich wieder in Keten umwandeln. Durch Kernspinresonanzspektroskopie wurde bewiesen, dass Diketen in der Ketonform vorliegt und nicht als Enol. Dies ist an dem Protonensignal bei 3.9 ppm mit der relativen Intensität von 2 zu erkennen, was dem Methylensignal entspricht.[6] Die exocyclische Methylidengruppe löst wie zu erwarten zwei getrennte Multipletts mit jeweils einer relativen Intensität von 1 aus.
Auch alkylierte Ketene dimerisieren leicht zu den entsprechend substituierten Diketenen.

Diketen reagiert leicht mit Alkoholen und Aminen zu Derivaten der Acetessigsäure.
Verwendung
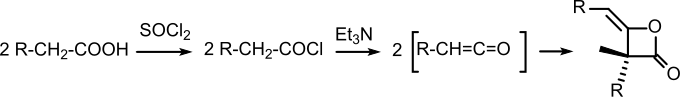
Diketen mit zwei längeren Alkylketten (so genannter „Ketenwachs“) wird bei der Papierherstellung zur Leimung (Hydrophobierung) von Papier verwendet, um die Bedruckbarkeit zu verbessern[7]. Neben den Kolophonium-Harzen mit ca. 60 % Anteil am Weltverbrauch sind die auch als Alkylketendimere (AKD) bezeichneten langkettigen Diketene mit 16 % Anteil die wichtigsten synthetischen Papierleimungsmittel und werden üblicherweise in Konzentrationen von 0,15 %, d. h. 1,5 kg festes AKD/t Papier eingesetzt. Die Herstellung von AKD erfolgt durch Herstellung der Säurechloride langkettiger Fettsäuren – wie etwa Stearinsäure – mittels beispielsweise Thionylchlorid und nachfolgende Eliminierung von HCl durch tertiäre Amine – beispielsweise Triethylamin – in Toluol, anderen Lösemitteln, oder lösemittelfrei in Masse.[8] Das zuerst gebildete monomere Keten dimerisiert schnell zum Diketen.[9]
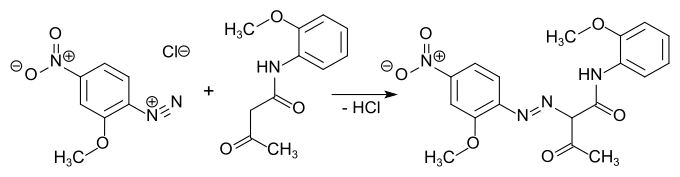
Diketen dient weiterhin als Zwischenprodukt bei der Herstellung von Pharmazeutika, Insektiziden und Farbstoffen. So entstehen mit substituierten Phenylhydrazinen die als Analgetika inzwischen weitgehend obsoleten Pyrazolone. Mit Methylamin reagiert Diketen zu Methylacetoacetamid, das mit Sulfurylchlorid chloriert und mit Trimethylphosphit zu dem hochgiftigen (insbesondere auch für Bienen) Insektizid Monocrotophos umgesetzt wird. Diketen reagiert mit substituierten aromatischen Aminen zu Acetoacetaniliden (Arylide), die wichtige Vorstufen für meist gelbe, orange oder rote Azofarbstoffe und Azopigmente darstellen.
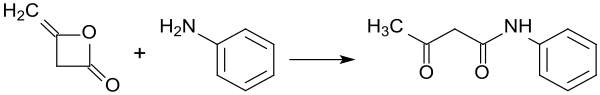
Beispielhaft für die Synthese von Aryliden durch Umsetzung von Diketen mit aromatischen Aminen ist die Darstellung von Acetoacetanilid[10]:
Aromatische Diazoniumverbindungen kuppeln mit Aryliden unter Bildung von Azofarbstoffen, wie z. B. Brilliantgelb (Pigment Yellow 74).
Die industrielle Synthese des Süßstoffs Acesulfam-K beruht auf der Umsetzung von Diketen mit Amidosulfonsäure und Cyclisierung mittels SO3[11]
Sicherheitshinweise
Die Dämpfe von 4-Methylen-2-oxetanon können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 33 °C, Zündtemperatur 275 °C) bilden.
Literatur
- Beilstein E III/IV 17: 4297 ff
Weblinks
Einzelnachweise
- ↑ a b c d e f g h i j k Eintrag zu 4-Methylen-2-oxetanon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-186.
- ↑ Eintrag zu But-3-en-3-olide in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 27. November 2020. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ a b Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte. 6. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 202.
- ↑ Mika L. Nakashige, Robert S. Lewis, William J. Chain: Transformation of N , N -dimethylaniline- N -oxides into N -methylindolines by a tandem Polonovski–Mannich reaction. In: Tetrahedron Letters. Band 56, Nr. 23, Juni 2015, S. 3531–3533, doi:10.1016/j.tetlet.2015.01.003.
- ↑ Andreas Pingel Keuth: Papierherstellung: Von Zellstoff zu Filtertüte, Schreibpapier, ... In: Chemie in unserer Zeit. 39, 6, Wiley-VCH, Weinheim 2005, S. 403–409. DOI:10.1002/ciuz.200500234
- ↑ Patent USUS5344943A: Long-chain ketene dimers. Angemeldet am 30. Dezember 1991, veröffentlicht am 29. Dezember 1992, Anmelder: Akzo Nobel NV, Erfinder: Nils Brolund.
- ↑ Wolf S. Schultz: Sizing Agents in Fine Paper (Seite nicht mehr abrufbar, festgestellt im Dezember 2023. Suche in Webarchiven) Abgerufen am 1. März 2012.
- ↑ G. Heckmann, F. Previdoli, T. Riedel, D. Ruppen, D. Veghini, U. Zacher: Process development and production concepts for the manufacturing of organic fine chemicals. In: CHIMIA. Band 60, Nr. 9, 2006, S. 530–533, doi:10.2533/chimia.2006.530.
- ↑ Patent EP0218076B1: Verfahren zur Herstellung der nicht-toxischen Salze des 6-Methyl-3,4-dihydro-1,2,3-oxathiazin-4-on-2,2-dioxids. Angemeldet am 27. August 1986, veröffentlicht am 3. Januar 1990, Anmelder: Hoechst, Erfinder: Dieter Reuschling, Adolf Linkies et al..


