Dibromamin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
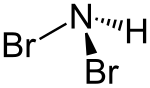
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Dibromamin | ||||||||||||
| Summenformel | NHBr2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 174,82 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Dibromamin ist eine anorganische Verbindung des Stickstoffs. Es handelt sich um ein Derivat des Ammoniaks, bei dem zwei Wasserstoffatome durch Brom ersetzt sind.
Herstellung
Dibromamin kann durch Reaktion von Ammoniak mit elementarem Brom in Diethylether unter Kühlung mit Trockeneis gewonnen werden. Dabei kann auch Monobromamin gebildet werden, jedoch entsteht durch sorgfältige Auswahl der Reaktionsbedingungen weitgehend selektiv nur eine von beiden Verbindungen.[2] Durch Änderung von pH-Wert und Mengenverhältnissen der Reagenzien kann die Reaktion zur Bildung von Monobromamin, Dibromamin oder Tribromamin geführt werden.[3]
Reaktionen
Durch Reaktion von Dibromamin mit Grignard-Verbindungen können primäre Amine hergestellt werden, jedoch nur in geringen Ausbeuten. Ein Großteil wird zu Ammoniak reduziert, daneben entstehen geringe Mengen an sekundären Aminen und an elementarem Stickstoff. Die Ausbeute an primärem Amin hängt auch von der konkreten Grignard-Verbindung ab. Während einige Verbindungen (Butylmagnesiumchlorid, sec-Butylmagnesiumchlorid, tert-Butylmagnesiumchlorid, tert-Butylmagnesiumbromid, Benzylmagnesiumchlorid und Phenethylmagnesiumchlorid) Ausbeuten von 15 bis über 30 % liefern, ergeben andere nur wenige Prozent an Aminen. Insbesondere waren brom- und iodbasierte Grignard-Verbindungen (Butylmagnesiumbromid, Butylmagnesiumiodid und tert-Butylmagnesiumiodid) überwiegend deutlich weniger zu deren Synthese geeignet. Ein ähnliches Reaktivitätsmuster ist auch von Monobromamin und Monochloramin bekannt.[2] Dibromamin addiert an Keten unter Bildung von Bromacetamid.[4]
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b George H. Coleman, Charles B. Yager, Harold Soroos: The Preparation of Dibromoamine and its Reaction with Grignard Reagents. In: Journal of the American Chemical Society. Band 56, Nr. 4, April 1934, S. 965–966, doi:10.1021/ja01319a066.
- ↑ Hend Galal-Gorchev, J. Carrell Morris: Formation and Stability of Bromamide, Bromimide, and Nitrogen Tribromide in Aqueous Solution. In: Inorganic Chemistry. Band 4, Nr. 6, Juni 1965, S. 899–905, doi:10.1021/ic50028a029.
- ↑ George H. Coleman, Rolf L. Peterson, Gilbert E. Goheen: The Reaction of Haloamines with Ketenes. In: Journal of the American Chemical Society. Band 58, Nr. 10, Oktober 1936, S. 1874–1876, doi:10.1021/ja01301a015.