Chrom(II)-bromid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
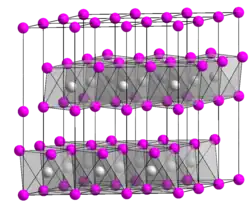
| |||||||||||||
| _ Cr2+ _ Br− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Chrom(II)-bromid | ||||||||||||
| Andere Namen |
Chromdibromid | ||||||||||||
| Verhältnisformel | CrBr2 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 211,80 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
4,356 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Chrom(II)-bromid ist eine anorganische chemische Verbindung des Chroms aus der Gruppe der Bromide.
Gewinnung und Darstellung
Chrom(II)-bromid kann durch Reduktion von Chrom(III)-bromid mit Wasserstoff gewonnen werden.[1]
Ebenfalls möglich ist die Darstellung durch Reaktion von Chrom(II)-acetat mit Bromwasserstoff.[1]
Eigenschaften
Chrom(II)-bromid ist ein weißer Feststoff, der in luftfreiem Wasser mit blauer Farbe löslich ist. An Luft oxidiert es rasch.[1] Die Schmelze nimmt eine gelbe Farbe an. Die Verbindung hat eine monokline Kristallstruktur mit der Raumgruppe C2/m (Raumgruppen-Nr. 12)[2] vom verzerrten Cadmium(II)-iodid-Typ.[4]
Einzelnachweise
- ↑ a b c d e f Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1481.
- ↑ a b c Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 392.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1453.