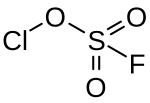
Chlorfluorosulfat
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Allgemeines | |||||||
| Name | Chlorfluorosulfat | ||||||
| Andere Namen |
Chlorfluorosulfonat | ||||||
| Summenformel | ClSO3F | ||||||
| Kurzbeschreibung |
blassgelbe Flüssigkeit[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 134,5 g·mol−1 | ||||||
| Aggregatzustand |
flüssig[1] | ||||||
| Dichte |
1,71 g·cm−3[1] | ||||||
| Schmelzpunkt | |||||||
| Siedepunkt |
43,4 °C (berechnet)[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Chlorfluorosulfat ist eine chemische Verbindung aus der Gruppe der Fluorosulfate.
Gewinnung und Darstellung
Chlorfluorosulfat kann durch Reaktion von Schwefeltrioxid mit Chlorfluorid bei tiefen Temperaturen[1]
oder durch Reaktion von Peroxydisulfuryldifluorid mit Chlor bei 125 °C unter Druck gewonnen werden.[1]
Eigenschaften
Chlorfluorosulfat ist eine äußerst reaktive blassgelbe Flüssigkeit, die mit Wasser sehr heftig reagiert.[3] Sie zersetzt sich beim Erwärmen auf Raumtemperatur unter Rotfärbung.[1]
Einzelnachweise
- ↑ a b c d e f g h Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 339.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ P.G. Urben; M.J. Pitt: Bretherick's Handbook of Reactive Chemical Hazards. 8. Edition, Vol. 1, Butterworth/Heinemann 2017, ISBN 978-0-08-100971-0, S. 781.