Cefprozil
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-cefprozil.svg.png) -cefprozil.svg.png)
| ||||||||||||||||||||||
| Oben: (Z)-Cefprozil; unten: (E)-Cefprozil | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Cefprozil[1] | |||||||||||||||||||||
| Andere Namen |
(6R,7R)-7-[(2R)-2-Amino-2-(4-hydroxyphenyl)acetamido]-8-oxo-3-[(1EZ)-prop-1-en-1-yl]-5-thia-1-azabicyclo[4.2.0]oct-2-en-2-carbonsäure | |||||||||||||||||||||
| Summenformel | C18H19N3O5S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
J01DC10 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 389,43 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Cefprozil ist ein Cephalosporin-Antibiotikum der zweiten Generation.[3][4] Der Wirkstoff behindert Bakterien beim Aufbau ihrer Zellwand. Verwendet wird es für die Behandlung von bakteriellen Infektionen. Cefprozil wird zur Behandlung von Pharyngitis, Tonsillitis, Ohrinfektionen, akuter Sinusitis, bakterieller Verschlimmerung chronischer Bronchitis[5] sowie Haut- und Weichteilinfektionen[6] eingesetzt.[7] Es ist oral wirksam und kann etwa als Tablette oder flüssige Suspension gegeben werden. Ursprünglich 1983 entdeckt und 1992 zugelassen,[8] wurde es von Bristol Myers Squibb unter dem Markennamen Cefzil in den USA bis 2010 verkauft, als die Markenversion eingestellt wurde.[9] Es ist weiterhin in generischer Form von verschiedenen Unternehmen erhältlich.
Nebenwirkungen
Obwohl häufig ein Kreuzallergie-Risiko von 10 % zwischen Cephalosporinen und Penicillinen angegeben wird, haben Studien gezeigt, dass für Cefprozil und mehrere andere Cephalosporine der zweiten Generation oder später kein erhöhtes Risiko für eine Kreuzallergie besteht.[10]
Zu den häufigsten Nebenwirkungen gehören erhöhte Leberwerte (einschließlich AST und ALAT), Schwindel, Eosinophilie, Windelausschlag und Superinfektionen, genitaler Juckreiz, Vaginitis, Durchfall, Übelkeit, Erbrechen und Bauchschmerzen.
Spektrum der bakteriellen Empfindlichkeit und Resistenz
Cefprozil ist nicht wirksam gegen die meisten Stämme von Bakterien der Gattungen oder Arten Enterobacter, Acinetobacter, Pseudomonas, Morganella morganii und Bacteroides fragilis. Empfindlich gegenüber Cefprozil sind Salmonella spp. und Streptokokken, ebenso wie die meisten Stämme von Moraxella catarrhalis und Streptococcus pneumoniae.[11]
Synthese
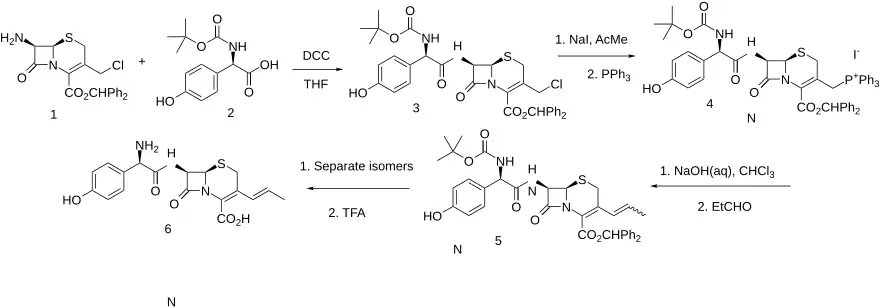
Die Verdrängung des allylischen Chlorids in Zwischenprodukt (1) mit Triphenylphosphin führt zum Phosphoniumsalz (2). Diese Funktionalität wird anschließend in ihr Ylid umgewandelt. Die Kondensation mit Acetaldehyd ergibt das Vinyl-Derivat (3). Nach der Abspaltung von Schutzgruppen entsteht schließlich Cefprozil. Es liegt als ~ 90:10 (Z/E)-Isomerengemisch vor.[12]
Eigenschaften
Cefprozil hat drei fix konfigurierte Stereozentren. Aufgrund der Doppelbindung in der Seitenkette am C-3 existieren zwei cis-trans-Isomere. Arzneilich eingesetzt wird der Wirkstoff als Cefprozil-Monohydrat. Das Diastereoisomerengemisch in pharmazeutischer Qualität enthält 6 % bis 11 % des (E)-Isomers.[13] Cefprozil-Monohydrat ist ein weißes oder gelbes, leicht hygroskopisches kristallines Pulver, das in Wasser und Methanol schwer löslich und in Aceton praktisch unlöslich ist.[13]
| Namen | Andere Namen | CAS-Nr. | Chemspider | Wikidata |
|---|---|---|---|---|
| Cefprozil, wasserfrei | Cefprozil | 92665-29-7 | 56685 | Q72516593 |
| (Z)-Cefprozil, wasserfrei | cis-Cefprozil, wasserfrei | 121412-77-9 | 4447586 | Q27292357 |
| (E)-Cefprozil, wasserfrei | trans-Cefprozil, wasserfrei | 92676-86-3 | 4444481 | Q3231623 |
| Cefprozil-Monohydrat | Cefprozil-Monohydrat (EAB) Ceprozil (USP) Cefprozil-Hydrat (1:1) |
121123-17-9 | 8063315 | Q72516597 |
| (Z)-Cefprozil-Monohydrat | cis-Cefprozil-Monohydrat (Z)-Cefprozil-Hydrat (1:1) |
114876-72-1 | 8063315 | Q27256443 |
| (E)-Cefprozil-Monohydrat | trans-Cefprozil-Monohydrat (E)-Cefprozil-Hydrat (1:1) |
111900-24-4 | 4941253 | Q27256965 |
Einzelnachweise
- ↑ INN Recommended List 29. In: who.int. Abgerufen am 1. März 2025 (englisch).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ S. L. Barriere: Pharmacology and pharmacokinetics of cefprozil. In: Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 14 Suppl 2, Juni 1992, S. S184–188; discussion S195–196, doi:10.1093/clinids/14.supplement_2.s184, PMID 1617036.
- ↑ Cefzil (cefprozil) dosing, indications, interactions, adverse effects, and more. Abgerufen am 27. Februar 2025 (englisch).
- ↑ Cefzil® (CEFPROZIL) Tablets 250 mg and 500 mg Cefzil® (CEFPROZIL) for Oral Suspension 125 mg/5 mL and 250 mg/5 mL. Bristol-Myers Squibb Company, Princeton, New Jersey, 08543 USA, November 2016, abgerufen am 27. Februar 2025 (englisch).
- ↑ T. Nolen: Comparative studies of cefprozil in the management of skin and soft-tissue infections. In: European Journal of Clinical Microbiology and Infectious Diseases. Band 13, Nr. 10, 1. Oktober 1994, S. 866–871, doi:10.1007/BF02111354.
- ↑ G. Aronovitz: Treatment of upper and lower respiratory tract infections: clinical trials with cefprozil. In: The Pediatric Infectious Disease Journal. Band 17, 8 Suppl, August 1998, S. S83–88, doi:10.1097/00006454-199808001-00007, PMID 9727656.
- ↑ IUPAC, János Fischer, C. Robin Ganellin: Analogue-based Drug Discovery. John Wiley & Sons, 2006, ISBN 978-3-527-60749-5 (google.de [abgerufen am 27. Februar 2025]).
- ↑ Determination That CEFZIL (Cefprozil) Tablets, 250 Milligrams and 500 Milligrams, and for Oral Suspension, 125 Milligrams/5 Milliliters and 250 Milligrams/5 Milliliters, Were Not Withdrawn From Sale for Reasons of Safety or Effectiveness. 11. September 2018, abgerufen am 27. Februar 2025 (englisch).
- ↑ Cephalosporins can be prescribed safely for penicillin-allergic patients. The Journal of Family Practice, Februar 2006, abgerufen am 27. Februar 2025 (englisch).
- ↑ Prescribing information: Cefzil® (CEFPROZIL) Tablets / Oral Suspension. In: www.accessdata.fda.gov. November 2016, abgerufen am 6. März 2025.
- ↑ Kozo Tomatsu, Shigeyuki Ando, Shinji Masuyoshi, Shoichiro Kondo, Minoru Hirano, Takeo Miyaki, Hiroshi Kawaguchi: The Journal of Antibiotics. August 1987, S. 1175–1183, abgerufen am 27. Februar 2025 (englisch).
- ↑ a b Monographie Cefprozil Monohydrate, European Pharmacopoeia 11th Edition (Ph. Eur. 11.0), EDQM Council of Europe, 2022.