Bursatellin
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
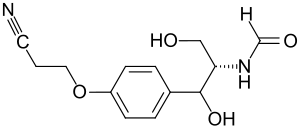
| ||||||||||
| Allgemeines | ||||||||||
| Name | Bursatellin | |||||||||
| Andere Namen |
N-[(2R)-1-[4-(2-cyanoethoxy)phenyl]-1,3-dihydroxypropan-2-yl]formamid | |||||||||
| Summenformel | C13H16N2O4 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 264,28 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Bursatellin ist eine organische Verbindung aus der Gruppe der Nitrile, die als Naturstoff in Meeresschnecken vorkommt.
Geschichte
Bursatellin wurde erstmals 1980 isoliert, wobei eine falsche Struktur ermittelt wurde, bei der beide Hydroxygruppen der Seitenkette an benachbarten Kohlenstoffatomen lagen und statt der Formamidgruppe am mittleren Atom dieser Seitenkette eine zweite terminale Nitrilgruppe vorhanden war. Eine korrigierte Struktur wurde 1987 publiziert.[2]
Vorkommen

Bursatellin wurde aus mehreren Unterarten von Bursatella leachii isoliert, einer Seeschneckenart der Familie Aplysiidae.[3]
Synthese
Eine mögliche Synthese von Bursatellin geht von geschütztem Tyrosin aus, mit einer Benzylgruppe am Hydroxy-O und einer Boc-Schutzgruppe am Amino-N. Diese Verbindung wird zunächst mit Diazomethan in den Methylester überführt, dieser mit Lithiumaluminiumhydrid in Tetrahydrofuran zum Alkohol reduziert und dieser wiederum mit Acetanhydrid als Acetat geschützt. Dieses Intermediat wird in Acetonitril vorgelegt und dann mit wässrigem Kaliumperoxodisulfat und wässrigem Kupfersulfat versetzt und auf 110 °C erhitzt. Dabei wird die Boc-Gruppe abgespalten und ein cyclisches Carbamat erhalten. Hydrolyse des Carbamats mit Kaliumhydroxid in Toluol führt zu einem Diol, anschließend wird durch Kochen in Ethylformiat die Aminogruppe formyliert. Unter Katalyse mit Palladium kann die Benzylgruppe durch Hydrierung entfernt werden. Die Diol-Einheit wird durch Umacetalisierung mit 2,2-Dimethoxypropan als Acetonid geschützt. Dieses Intermediat kann mit 1,2-Dibromethan und Kaliumcarbonat in Ethanol umgesetzt werden, um an der phenolischen Hydroxygruppe eine weitere C2-Einheit anzubringen. Die Nitrilgruppe wird durch Reaktion mit Natriumcyanid in Dimethylsulfoxid angebracht. Entschützung des Acetonids mit Essigsäure ergibt das Produkt Bursatellin.[4]
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Guido Cimino, Margherita Gavagnin, Guido Sodano, Aldo Spinella, Giuseppe Strazzullo, Francis J. Schmitz, Gopichand Yalamanchili: Revised structure of bursatellin. In: The Journal of Organic Chemistry. Band 52, Nr. 11, Mai 1987, S. 2301–2303, doi:10.1021/jo00387a037.
- ↑ Guido Cimino, Margherita Gavagnin, Guido Sodano, Aldo Spinella, Giuseppe Strazzullo, Francis J. Schmitz, Gopichand Yalamanchili: Revised structure of bursatellin. In: The Journal of Organic Chemistry. Band 52, Nr. 11, Mai 1987, S. 2301–2303, doi:10.1021/jo00387a037.
- ↑ Katsumi Kawamine, Rie Takeuchi, Masaaki Miyashita, Hiroshi Irie, Keiko Shimamoto, Yasufumi Ohfune: A Synthesis of (−)-Bursatellin. In: Chemical and Pharmaceutical Bulletin. Band 39, Nr. 12, 1991, S. 3170–3171, doi:10.1248/cpb.39.3170.