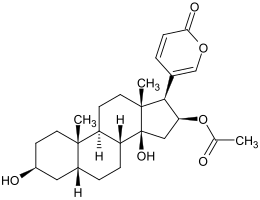
Bufotalin
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Bufotalin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C26H36O6 | |||||||||
| Kurzbeschreibung |
weißer bis gelblicher Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 444,57 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Bufotalin ist eine organische Verbindung aus der Gruppe der Steroide, genauer der Bufadienolide.
Vorkommen

Bufotalin kommt als Naturstoff bei vielen Arten der Kröten (Bufonidae) vor. Beispielsweise wurde es in einer Studie als Hauptkomponente der Gifte von Stummelfußfröschen nachgewiesen.[2] Auch in Bufo gargarizans und der Schwarznarbenkröte kommt die Verbindung vor.[3]
Synthese
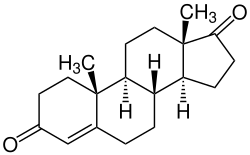
Eine mögliche Synthese von Bufotalin geht von Androstendion aus. Zunächst wird mittels Palladium / Wasserstoff die Doppelbindung hydriert. Die 3-Ketongruppe wird mittels Kaliumtri-sec-butylborhydrid reduziert und mit tert-Butyldimethylsilylchlorid geschützt. Die Hydroxygruppe in Position 14 wird in drei Schritten eingeführt: Durch Reaktion mit Trimethylsilyltriflat und Palladiumacetat (Ito-Saegusa-Oxidation) wird zunächst an den Positionen 15 und 16 eine Doppelbindung eingeführt. Diese wird durch Reaktion in einer Isomerisierung mit Ethyldiisopropylamin in Perfluortoluol an die Position 14/15 verschoben. Oxidation mit Sauerstoff in Gegenwart von Cobalt(II)-acetylacetonat und Phenylsilan ermöglicht dann die Hydroxylierung. Durch Reaktion mit Hydrazin und elementarem Iod wird in einer Hydrazon-Iodierung die 17-Ketongruppe in ein Iodalken umgewandelt, das in einer Stille-Kupplung mit 5-Trimethylstannyl-2-pyron und Tetrakis(triphenylphosphin)palladium(0) umgesetzt wird, um die 2-Pyron-Gruppe anzubringen. Die C16/C17-Doppelbindung wird mit meta-Chlorperbenzoesäure epoxidiert, das Epoxid mit Trimethylsilyltriflat in Gegenwart von 2,6-Lutidin zum Keton isomerisiert, wobei gleichzeitig die C14-Hydroxygruppe in einen Silylether umgewandelt wird. Reduktion des Ketons mit Natriumborhydrid, Acetylierung mit Acetanhydrid und Entschützung der Silylether mit Pyridin/HF (Olah-Reagenz) führt zum Bufotalin.[4]
Eigenschaften
Bufotalin zeigt cytotoxische Eigenschaften, insbesondere gegen Leberkrebs-Zellen.[4]
Einzelnachweise
- ↑ a b c d Eintrag zu Bufotalin, >98.0% bei TCI Europe, abgerufen am 12. Mai 2025.
- ↑ Kannon C. Pearson, Rebecca D. Tarvin: A review of chemical defense in harlequin toads (Bufonidae: Atelopus). In: Toxicon: X. Band 13, März 2022, S. 100092, doi:10.1016/j.toxcx.2022.100092, PMID 35146414, PMC 8801762 (freier Volltext).
- ↑ Huimin Gao, Martin Zehl, Alexander Leitner, Xiyan Wu, Zhimin Wang, Brigitte Kopp: Comparison of toad venoms from different Bufo species by HPLC and LC-DAD-MS/MS. In: Journal of Ethnopharmacology. Band 131, Nr. 2, September 2010, S. 368–376, doi:10.1016/j.jep.2010.07.017.
- ↑ a b Nuo Chen, Yunqiang Wu, Huamao Wei, Shuai Zhi, Liwei Liu: The advancement of structure, bioactivity, mechanism, and synthesis of bufotalin. In: Steroids. Band 214, Februar 2025, S. 109555, doi:10.1016/j.steroids.2024.109555.
