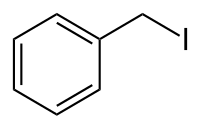
Benzyliodid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Benzyliodid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C7H7I | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelbe Nadeln[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 218,035 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,7335 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,6334 (25 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Benzyliodid ist eine organisch-chemische Verbindung aus der Stoffgruppe der Alkylhalogenide und hat die Summenformel C7H7I. Es ist ein Konstitutionsisomer zu den Iodtoluolen.
Herstellung
Benzyliodid kann durch Finkelstein-Reaktion aus Benzylchlorid und Natriumiodid in Aceton hergestellt werden.[3]
Eigenschaften
Benzyliodid bildet farblose bis gelbe Nadeln, die bei 24,5 °C schmelzen.[1] Als Flüssigkeit besitzt es den hohen Brechungsindex von 1,6334.[1] Benzyliodid ist ein starker Augenreizstoff, bereits 0,002 mg pro Liter Luft rufen Tränenfluss hervor.[4]
Einzelnachweise
- ↑ a b c d e f g h David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-306.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von α-iodotoluene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Dezember 2024.
- ↑ T. M. Brown, C. J. Cooksey, A. T. Dronsfield, A. S. Wilkinson: Cobaloximes as Environmentally Advantageous Alternatives to Organotin Hydrides in Iodine Atom Abstraction Routes to Benzyl Radicals. In: Applied Organometallic Chemistry. Band 10, Nr. 6, August 1996, S. 415–420, doi:10.1002/(SICI)1099-0739(199608)10:6<415::AID-AOC493>3.0.CO;2-7.
- ↑ Fieser und Fieser: Organische Chemie, 2. Auflage, Verlag Chemie, Weinheim 1982, ISBN 3-527-25075-1.

