Bariumchromat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
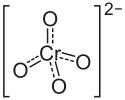
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bariumchromat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | BaCrO4 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 253,32 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
4,5 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt |
210 °C[2] | ||||||||||||||||||
| Löslichkeit |
sehr schwer in Wasser (0,34 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
0,5 mg·m−3 Barium[3] | ||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Bariumchromat ist ein Bariumsalz der Chromsäure. Es besitzt die Formel BaCrO4 und gehört zu Stoffgruppe der Chromate.
Vorkommen

Als natürliche Mineralbildung wurde Bariumchromat erstmals in der Lisdan-Siwaga Falte im Daba-Siwaqa-Komplex innerhalb der Region Hashem des jordanischen Gouvernement Amman entdeckt und von Phoebe L. Hauff, Eugene E. Foord, Sam Rosenblum und Walid Hakki erstbeschrieben.[5] Das Mineral wurde 1978 von der International Mineralogical Association unter dem Namen Hashemit (IMA 1978-006) anerkannt.[6]
Gewinnung/Darstellung
Das gelbe Bariumchromat wird durch Fällung von Bariumionen mit Chromationen aus leicht saurer Lösung gewonnen.
Eigenschaften

Bariumchromat ist ein gelber Feststoff, der praktisch wasserunlöslich und deswegen im Gegensatz zu den meisten anderen Chromaten nicht akut giftig ist, so dass die Sicherheitshinweise für lösliche Chromate für Bariumchromat nur eingeschränkt gelten. Andererseits sind gerade schwerlösliche Chromatpartikel im Falle inhalatorischer Exposition besonders stark karzinogen und Bariumchromat zeigt eine Klastogenwirkung, die über die klassischen genotoxischen Wirkungen löslicher Chrom(VI)-Verbindungen hinausgeht.[7] Wie alle Chromate wirkt auch Bariumchromat oxidierend, besonders stark unter sauren Bedingungen. Es zeigt die für Barium typische grüne Flammenfärbung.
Beim Erhitzen mit Bariumcarbonat wird das sechswertige Chrom zum fünfwertigen reduziert, es bildet sich Bariumchromat(V) Ba3(CrO4)2.[8]
Verwendung
Bariumchromat wird in der Glas- und Farbenindustrie als Pigment eingesetzt. In der Pyrotechnik wird Bariumchromat als Oxidationsmittel und zur Grünfärbung verwendet.
Einzelnachweise
- ↑ Eintrag zu Bariumchromat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Juni 2014.
- ↑ a b c d e f Eintrag zu Bariumchromat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt Bariumchromat bei Alfa Aesar, abgerufen am 14. März 2010 (Seite nicht mehr abrufbar).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag barium salts, with the exception of barium sulphate, salts of 1-azo-2-hydroxynaphthalenyl aryl sulphonic acid, and of salts specified elsewhere in this Annex in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 23. August 2025. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Phoebe L. Hauff, Eugene E. Foord, Sam Rosenblum, Walid Hakki: Hashemite, Ba(Cr,S)O4, a new mineral from Jordan. In: American Mineralogist. Band 68, 1983, S. 1223–1225 (englisch, rruff.info [PDF; 302 kB; abgerufen am 7. Juli 2025]).
- ↑ Malcolm Back, Cristian Biagioni, William D. Birch, Michel Blondieau, Hans-Peter Boja und andere: The New IMA List of Minerals – A Work in Progress – Updated: July 2025. (PDF; 3,2 MB) In: cnmnc.units.it. IMA/CNMNC, Marco Pasero, Juli 2025, abgerufen am 7. Juli 2025 (englisch).
- ↑ S. S. Wise, A. L. Holmes, Q. Qin, H. Xie, S. P. Katsifis, W. D. Thompson, J. P. Wise: Comparative genotoxicity and cytotoxicity of four hexavalent chromium compounds in human bronchial cells. In: Chemical research in toxicology. Band 23, Nummer 2, Februar 2010, S. 365–372, doi:10.1021/tx900363j, PMID 20000473, PMC 2822000 (freier Volltext).
- ↑ K. A. Wilhelmi, O. Jonsson: X-Ray Studies on Some Alkali and Alkaline-Earth Chromates(V). In: Acta Chemica Scandinavica 1965, 19, S. 177–184, doi:10.3891/acta.chem.scand.19-0177.


