Bariumtellurit
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
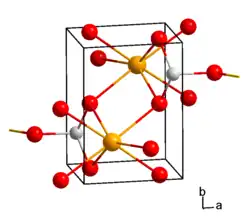
| ||||||||||
| Kristallstruktur von Bariumtellurit _ Ba2+ _ Te4+ _ O2− | ||||||||||
| Allgemeines | ||||||||||
| Name | Bariumtellurit | |||||||||
| Andere Namen |
Bariumtellurtrioxid | |||||||||
| Verhältnisformel | BaTeO3 | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 312,92 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
5,57 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Bariumtellurit ist eine chemische Verbindung des Bariums aus der Gruppe der Tellurite mit der Summenformel BaTeO3. Neben diesem sind weitere Bariumtellurite (zum Beispiel Ba4TeO11) bekannt.[6]
Gewinnung und Darstellung
Bariumtellurit kann durch Reaktion von Bariumoxid oder Bariumcarbonat[2] mit Tellurdioxid in einer inerten Atmosphäre gewonnen werden.[6]
Sie kann auch durch Reaktion einer Lösung von Bariumchlorid mit Natriumtellurit gewonnen werden, wobei das Trihydrat oder Monohydrat entsteht.[6]
Ebenfalls möglich ist die Synthese durch Reaktion von Bariumchlorid mit Tellurdichlorid in Wasser.[6]
Eigenschaften
Bariumtellurit tritt in zwei Modifikationen auf. Die eine besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14), die andere eine orthorhombische mit der Raumgruppe Pmna (Raumgruppen-Nr. 53). In beiden Polymorphen finden sich isolierte, pyramidenförmige TeO3-Gruppen, die zusätzlich einen deutlich längeren Te–O-Abstand zeigen. Die monokline Form ist strukturell dem Kaliumperchlorat verwandt.[2] Das Monohydrat von Bariumtellurit besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3).[6]
Einzelnachweise
- ↑ a b F. Folger: Die Kristallstruktur von BaTeO3. In: Zeitschrift für anorganische und allgemeine Chemie. Band 411, Nr. 2, 1975, S. 111–117, doi:10.1002/zaac.19754110204.
- ↑ a b c M. Koçak, Chr. Platte, M. Trömel: Über Verschiedene Formen von BaTeO3. In: Zeitschrift für anorganische und allgemeine Chemie. 453, 1979, S. 93, doi:10.1002/zaac.19794530611.
- ↑ J. Osińska, E. Kłoczko, Z. Gontarz: Reactions of tellurates(IV) of some 2nd group metals with basic oxides. In: Journal of thermal analysis. Band 43, Nr. 1, 1995, S. 227–230, doi:10.1007/BF02635989.
- ↑ Eintrag zu Bariumsalze in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Dezember 2024. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag barium salts, with the exception of barium sulphate, salts of 1-azo-2-hydroxynaphthalenyl aryl sulphonic acid, and of salts specified elsewhere in this Annex in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Dezember 2024. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c d e Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 193 (eingeschränkte Vorschau in der Google-Buchsuche).
