Bariumnitrit
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
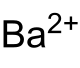 
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bariumnitrit | ||||||||||||||||||
| Verhältnisformel | BaN2O4 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 229,34 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
270 °C (Zersetzung)[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Bariumnitrit ist eine anorganische chemische Verbindung des Bariums aus der Gruppe der Nitrite.
Gewinnung und Darstellung
Bariumnitrit-Monohydrat kann durch Reaktion einer stöchiometrischen Lösung von Bariumchlorid mit Natriumnitrit gewonnen werden.[1] Bei Erwärmung wandelt sich das Monohydrat bei 372 K in das Hemihydrat, bei 425 K in das 1/3-Hydrat und bei 457 K in das Anhydrat um.[4]
Eigenschaften
Bariumnitrit ist eine farbloser Feststoff, der gut löslich in Wasser ist. Er zersetzt sich bei einer Temperatur von 270 °C zu Bariumoxid, Stickoxiden und Stickstoff.[1] Das Monohydrat ist ein weißer bis gelber kristalliner Feststoff, der löslich in Wasser und Ethanol ist.[1] Es ist stark pyroelektrisch.[4]
Das Anhydrat besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe P212121 (Raumgruppen-Nr. 19).[5] Das Monohydrat besitzt eine hexagonale Kristallstruktur Raumgruppe P61 (Raumgruppen-Nr. 169).[6] Es sind jedoch abhängig von der Temperatur noch weitere Modifikationen bekannt.[7][8]
Verwendung
Bariumnitrit-Monohydrat wird als Korrosionsschutzmittel, in Sprengstoffen und zur Diazotierung verwendet.[1]
Einzelnachweise
- ↑ a b c d e f g h i j k l Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Bariumsalze in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Dezember 2024. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag barium salts, with the exception of barium sulphate, salts of 1-azo-2-hydroxynaphthalenyl aryl sulphonic acid, and of salts specified elsewhere in this Annex in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Dezember 2024. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Hitoshi Kawaji, Kazuya Saito, Tooru Atake, Yasutoshi Saito: Phase relation and dehydration behavior of barium nitrite hydrates. In: Thermochimica Acta. Band 127, 1988, S. 201–208, doi:10.1016/0040-6031(88)87496-3.
- ↑ Wolfgang Bensch, Armin Reller: Crystal structure of barium nitrite, Ba (NO2)2. In: Zeitschrift für Kristallographie - Crystalline Materials. Band 175, Nr. 1–4, 1986, S. 111–116, doi:10.1524/zkri.1986.175.14.111.
- ↑ G. Schäfer, K. F. Fischer: Die Struktur von Bariumnitrit-Monohydrat Ba(NO2)2 · H2O. In: Zeitschrift für Kristallographie - Crystalline Materials. Band 155, Nr. 1–4, 1981, S. 75–80, doi:10.1524/zkri.1981.155.14.75.
- ↑ S. C. Abrahams, P. K. Gallagher, H. M. O′Bryan, R. Liminga: Phase transitions at 462 and 495 K in barium nitrite. In: Journal of Applied Physics. Band 52, Nr. 4, 1981, S. 2837–2840, doi:10.1063/1.329014.
- ↑ R. C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Elsevier Science, 2012, ISBN 0-444-59553-8, S. 213 (eingeschränkte Vorschau in der Google-Buchsuche).
