Aortenklappenrekonstruktion
Als Aortenklappenrekonstruktion bezeichnet man die Wiederherstellung der Form und somit Funktion der natürlichen, funktionsgestörten Aortenklappe, im Gegensatz zum Ersatz der Klappe durch eine mechanische oder biologische Prothese. Meist wird die Aortenklappenrekonstruktion bei Aortenklappeninsuffizienz durchgeführt, sie kann auch bei Aortenaneurysma erforderlich werden, seltener bei der angeborenen Aortenstenose. Ein möglicher Vorteil gegenüber dem Klappenersatz ist das Fehlen der prothesenassoziierten Komplikationen (Thrombose, Infekt, Abstoßung).[1][2] Prospektiv-randomisierte Studien, die die konkurrierenden Techniken bewerten können, stehen noch aus. Eine retrospektive Auswertung über 1071 Behandlungsfälle ergab mit dem Klappenersatz vergleichbare kurzfristige Erfolge für die Rekonstruktion, allerdings deutlich häufigere Nachoperationen.[3] Die 2021 veröffentlichte Leitlinie der europäischen Fachgesellschaften empfiehlt den Klappenersatz weiterhin als Standardeingriff und beschränkt den Einsatz der Klappenrekonstruktion auf die Behandlung der Aorteninsuffizienz bei „ausgewählten, jüngeren Patienten“ durch besonders erfahrene Chirurgen.[4]
Geschichte
Bereits vor der Entwicklung von Herzklappenprothesen wurden erste Versuche unternommen funktionsgestörte Aortenklappen zu rekonstruieren. Die Sprengung einer verengten Aortenklappe wurde 1912 durch den französischen Chirurgen Théodore Tuffier (1857–1929)[5] durchgeführt. 1958 berichtete Dwight Harken über eine kleine Gruppe an Patienten mit Aortenklappeninsuffizienz, bei denen er den Klappenring verkleinert und die Insuffizienz verringert hatte.[6] Zur damaligen Zeit hatten Chirurgen und Kardiologen nur minimale Informationen über die Art und Schwere der Funktionsstörung der Aortenklappe. Dies änderte sich langsam nach der Einführung der Echokardiographie durch Inge Edler und Carl Hellmuth Hertz. Der Herzklappenersatz vor allem für die Aortenklappe wurde zu einer Standardbehandlung. Die erste Kugelprothese wurde 1961 durch die Amerikaner Albert Starr und Lowell Edwards implantiert; später folgten verbesserte mechanische und biologische Prothesen (Schweineherzklappen). Bei Kindern mit angeborenen Herzfehlern wurden ab ca. 1960 verschiedene Raffungsnähte erprobt. In den 1980er und 90er Jahren kamen komplexere rekonstruierende Techniken hinzu, beginnend mit Magdi Yacoub (1983) und Tirone E. David (1993), die die Klappendurchmesser mit angesetzten Kunststoffimplantaten stabilisierten.[7]
Indikation
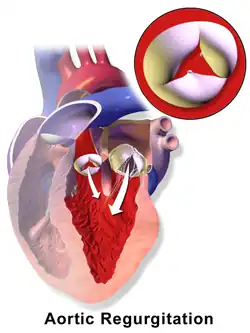
Eine Aortenklappenrekonstruktion ist möglich, wenn keine ausgeprägte Verkalkung der Aortenklappe vorliegt. Dies schließt die im Leben erworbenen Klappenstenosen (Verengungen) aus; allerdings nicht die angeborenen Aortenklappenstenosen.[8] Häufiger ist die Aortenklappenrekonstruktion zur Behandlung der Aortenklappeninsuffizienz, etwa beim Marfan-Syndrom.[9] Sie kann auch während einer Operation bei Aneurysma der Aorta ascendens zum Einsatz kommen.[10]
Es wird nur bei schweren Klappenfehlern mit Symptomen operiert oder bei Komplikationen der linken Herzkammer (Ejektionsfraktion < 50 %, Vergrößerung des Ventrikels > 65 mm). Für die chirurgische Versorgung des Aortenaneurysmas ist dessen Durchmesser maßgeblich (> 50 mm und Risikofaktoren, sonst > 55 mm).
Operationstechnik
Operationen mit Rekonstruktion der Aortenklappe werden üblicherweise durch eine Sternotomie (Eröffnen des Brustbeins) durchgeführt. Minimal-invasive Techniken erschweren die Beurteilung der Klappenform. Die Herz-Lungenmaschine wird an Aorta und rechten Vorhof angeschlossen. Eine sorgfältige echokardiografische Untersuchung (transösophageale Echokardiografie) ist erforderlich, um die Formabweichungen der Aortenklappe und damit die Ursachen der Aortenklappeninsuffizienz exakt zu bestimmen. Das Herz wird durch Kardioplegie stillgelegt und die Aortenklappe systematisch analysiert. Heute gibt es bereits bekannte Sollwerte für einzelne Formaspekte der Aortenklappe, so dass nach Echokardiografie und intraoperativer Analyse die Ursache der Aorteninsuffizienz fast immer genau bestimmt werden kann. Die Resultate der Analyse, die Art einer möglichen angeborenen Fehlbildung und das Vorliegen eines Aneurysmas der Aorta ascendens bestimmen den Plan der Aortenklappenrekonstruktion, der für jeden Patienten individuell festgelegt werden muss.[11]
Aortenklappenstenose
Bei der angeborenen Aortenklappenstenose (Verengung) liegt nahezu immer eine unikuspide Aortenklappe vor (nur ein Segel statt drei); diese muss in ihrer Konfiguration so geändert werden, dass die Klappe besser öffnet. Eine einfache Sprengung/Auftrennung (Ballovalvuloplastie oder Kommissurotomie) würde in Aorteninsuffizienz resultieren.[12] Die Rekonstruktion schafft zusätzlich einen oder zwei zusätzliche Aufhängepunkte (Kommissuren). Somit wird aus der unikuspiden Aortenklappe eine bikuspide gemacht. Dies führt zu einer annähernd normalen Funktion der Aortenklappe. Mithilfe von Flickenmaterial werden die Taschen so ergänzt, dass ihr Material dann bis zu einer zweiten, neu geschaffenen Kommissur reicht.
Aortenklappeninsuffizienz
Trikuspide Aortenklappe
Bei trikuspider Aortenklappe liegt eine normale Anlage der Klappe vor. Wenn die Aorta erweitert ist, kommt das Konzept zur Behandlung des Aortenaneurysmas zum Einsatz. Ohne Erweiterung der Aorta liegt die Ursache der Undichtigkeit häufig in der Überdehnung des Gewebes eines oder mehrerer der Klappenelemente (Taschen). Eine solche Überdehnung kann kombiniert sein mit angeborenen Gewebslücken in den Taschen, sogenannten Fenestrationen. Eine Erweiterung des Klappenrings der Aortenklappe kann zusätzlich zur Insuffizienz beitragen. In Mitteleuropa seltener ist die Schrumpfung der Taschen als Ursache der Insuffizienz; dies ist zurzeit nicht gut mit einer Rekonstruktion behandelbar. Eine Schrumpfung muss deshalb ausgeschlossen werden. Das Ausmaß der Überdehnung wird exakt bestimmt und dann die Überlänge an Gewebe durch raffende Nähte reduziert. Eine Ringerweiterung macht die zusätzliche Verkleinerung und Stabilisierung des Aortenklappenrings erforderlich. Die Überdehnung wird dadurch korrigiert, dass das überschüssige Ausmaß von Klappengewebe durch einzelne Abnäher auf ein normales Maß verkürzt wird. Am Ende der Operation sollten die Taschenränder symmetrisch zueinander stehen.
Bikuspide Aortenklappe

Bei bikuspider Anlage der Aortenklappe liegt eine Verschmelzung zweier Taschen der Aortenklappe seit Geburt vor. Da die bikuspide Anlage der Aortenklappe eine befriedigende Ventilfunktion besitzt, belässt man die Aortenklappe als bikuspide; es werden lediglich die Veränderungen korrigiert, die zur Insuffizienz geführt haben. Das Ausmaß der Überdehnung wird exakt bestimmt und dann die Überlänge an Gewebe durch raffende Nähte reduziert. Eine Ringerweiterung macht die zusätzliche Verkleinerung und Stabilisierung des Aortenklappenrings erforderlich. Wie bei der trikuspiden Aortenklappe wird die Klappe vermessen, um eine Schrumpfung des Klappengewebes auszuschließen. Der Ring ist meist erweitert, er muss durch eine sogenannte Anuloplastie[13] verkleinert und stabilisiert werden. Zusätzlich wird die Überdehnung des Taschengewebes durch raffende Nähte korrigiert. Am Ende der Operation sollten die Taschenränder symmetrisch zueinander stehen.
Unikuspide Aortenklappe
Die Rekonstruktion öffnet bzw. trennt die angeborenen Verwachsungen der Taschen, sie schafft zusätzlich einen oder zwei zusätzliche Aufhängepunkte (Kommissuren). Somit wird aus der unikuspiden Aortenklappe eine bikuspide gemacht. Dies führt zu einer annähernd normalen Funktion der Aortenklappe. Mithilfe von Flickenmaterial werden die Taschen so ergänzt, dass ihr Material dann bis zu einer zweiten (neu geschaffenen) Kommissur reicht. Der Ring ist meist erweitert, er muss verkleinert und stabilisiert werden.
Quadrikuspide Aortenklappe
Die Aortenklappeninsuffizienz bei quadrikuspider Aortenklappe ist meist bedingt durch die zusätzliche Kommissur, die den korrekten Schluss der Taschen behindert. Das Konzept zur Rekonstruktion besteht in einer Umwandlung in eine trikuspide[14] oder bikuspide (luciani) Aortenklappe. Hierzu wird das Klappengewebe von einer oder zwei Kommissur/en abgelöst und die Klappe in eine passende Form gebracht. Meist ist es naheliegend, eine der 4 Kommissuren abzulösen und das Gewebe der beiden beteiligten Taschen so durch Nähte zu vereinigen, dass eine Aortenklappe mit normaler Form resultiert.
Aneurysma der Aorta ascendens
Die Erweiterung der Aorta (Aneurysma) in ihrem Anfangsteil kann zu einer behandlungsbedürftigen Aortenklappeninsuffizienz führen, indem die Taschen der Klappe ihre Schließfähigkeit verlieren. In der überwiegenden Mehrzahl der Fälle ist bei der Operation eines Aneurysmas der Aorta ascendens auch ein Klappenersatz oder eine Aortenklappenrekonstruktion[15] erforderlich, wenn eine möglichst normale Funktion der Aortenklappe erreicht werden soll.
Nachsorge
Antikoagulation
Im Gegensatz zum Klappenersatz ist nach der Rekonstruktion keine Hemmung der Blutgerinnung (Antikoagulation) erforderlich. Lediglich das Auftreten von unregelmäßigem Herzschlag (Vorhofflimmern) kann eine Antikoagulation erfordern, um die Bildung von Gerinnseln im linken Vorhof zu verhindern.
Endokarditisprophylaxe
Nach Aortenklappenersatz ist eine Endokarditisprophylaxe bei allen Eingriffen im Bereich des Mund-Rachen-Raums (z. B. Zahnchirurgie, Tonsillektomie) empfohlen.[16] Es ist unklar, ob dies auch nach einer Herzklappenrekonstruktion notwendig ist.
Siehe auch
Literatur
- Hans-Joachim Schäfers: Current treatment of aortic regurgitation. UNI-MED Science, Bremen/London/Boston 2013, ISBN 978-3-8374-1406-6.
- Hans-Joachim Schäfers: Klinische Grundlagen der Herz- und Thoraxchirurgie. 1. Auflage. ABW Wissenschaftsverlagsgesellschaft, Berlin 2003.
Einzelnachweise
- ↑ Ilias P. Doulamis, Athanasios Rempakos, Eric W. Etchill, Alexandros Briasoulis: Aortic Valve Surgery: Fix the Valve or Use a New One? In: Journal of Clinical Medicine. Band 11, Nr. 16, 18. August 2022, ISSN 2077-0383, S. 4844, doi:10.3390/jcm11164844, PMID 36013079, PMC 9410533 (freier Volltext) – (mdpi.com [abgerufen am 7. Mai 2025]).
- ↑ D Aicher et al.: Aortic valve repair leads to a low incidence of valve-related complications. In: Eur J Cardiothorac Surg., 2010, 37, S. 127–132.
- ↑ Chris Ho Ming Wong, Jeffrey Shi Kai Chan, Dilan Sanli, Rashad Rahimli, Amer Harky: Aortic valve repair or replacement in patients with aortic regurgitation: A systematic review and meta-analysis. In: Journal of Cardiac Surgery. Band 34, Nr. 6, 2019, ISSN 1540-8191, S. 377–384, doi:10.1111/jocs.14032 (wiley.com [abgerufen am 7. Mai 2025]).
- ↑ Alec Vahanian, Friedhelm Beyersdorf, Fabien Praz, Milan Milojevic, Stephan Baldus, Johann Bauersachs, Davide Capodanno, Lenard Conradi, Michele De Bonis, Ruggero De Paulis, Victoria Delgado, Nick Freemantle, Martine Gilard, Kristina H Haugaa, Anders Jeppsson, Peter Jüni, Luc Pierard, Bernard D Prendergast, J Rafael Sádaba, Christophe Tribouilloy, Wojtek Wojakowski, ESC/EACTS Scientific Document Group, ESC National Cardiac Societies: 2021 ESC/EACTS Guidelines for the management of valvular heart disease: Developed by the Task Force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). In: European Heart Journal. Band 43, Nr. 7, 14. Februar 2022, ISSN 0195-668X, S. 561–632, doi:10.1093/eurheartj/ehab395 (oup.com [abgerufen am 7. Mai 2025]).
- ↑ Barbara I. Tshisuaka: Tuffier, Théodore. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/New York 2005, ISBN 3-11-015714-4, S. 1424.
- ↑ WJ Taylor et al.: The surgical correction of aortic insufficiency by circumcision. In: J Thorac Cardiovasc Surg., 1958,35, S. 192–231.
- ↑ Pavel Žáček, Jan Vojáček, Jan Dominik, Jan Harrer: A history of the surgical treatment of aortic regurgitation. In: Cor et Vasa (= Cardiovascular Surgery). Band 57, Nr. 2, 1. April 2015, ISSN 0010-8650, S. e149–e155, doi:10.1016/j.crvasa.2015.03.002 (sciencedirect.com [abgerufen am 7. Mai 2025]).
- ↑ HJ Schäfers et al.: Bicuspidization of the unicuspid aortic valve: a new reconstructive approach. In: Ann Thorac Surg., 2008 Jun, 85(6), S. 2012–2018
- ↑ D Aicher, HJ. Schäfers: Aortic valve repair – current status, indications, and outcomes. In: Semin Thorac Cardiovasc Surg., 2012, 24(3), S. 195–201
- ↑ A Vahanian et al.: Guidelines on the management of valvular heart disease (version 2012). In: Eur Heart J., 2012 Oct, 33(19), S. 2451–2496.
- ↑ F Langer et al.: Aortic valve repair using a differentiated surgical strategy. In: Circulation, 2004, 110, S. II 67-73.
- ↑ RH. Anderson: Understanding the structure of the unicuspid and unicommissural aortic valve. In: J Heart Valve Dis., 2003 Nov; 12(6), S. 670–673.
- ↑ D Aicher, U Schneider, W Schmied, T Kunihara, M Tochii, HJ. Schäfers: Early results with annular support in reconstruction of the bicuspid aortic valve. In: J Thorac Cardiovasc Surg., 2013 Mar, 145(3 Suppl), S. S30–534.
- ↑ KI Schmidt et al. Tricuspidization of the quadricuspid aortic valve. Ann Thorac Surg. 2008 Mar;85(3), S. 1087–1089.
- ↑ HJ Schäfers et al.: Remodeling of the aortic root and reconstruction of the bicuspid aortic valve. In: Ann Thorac Surg., 2000, 70, S. 542–546. M Franciulli et al.: Root remodeling and aortic valve repair for unicuspid aortic valve. In: Ann Thorac Surg., 2014, Sep, 98(3), S. 823–829.
- ↑ Endokarditisprophylaxe nach den neuen Guidelines der Europäischen Kardiologischen Gesellschaft. (PDF; 869 kB) In: Journal für Kardiologie, 2011, abgerufen am 19. Juni 2011.