Ammoniumiodid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
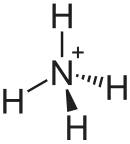 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumiodid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | NH4I | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser, scharf salzig schmeckender, stark hygroskopischer Feststoff[2][3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 144,94 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,51 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt |
551 °C (sublimiert)[4] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Ammoniumiodid (NH4I) ist eine anorganische chemische Verbindung und das Ammoniumsalz des Iodwasserstoffs. Ammoniumiodid ist ein farb- und geruchloser, scharf salzig schmeckender, stark hygroskopischer Feststoff.
Eigenschaften
Ammoniumiodid ist ein farb- und geruchloser, scharf salzig schmeckender, stark hygroskopischer Feststoff, der in Wasser, Ethanol, Methanol und Glycerin leicht löslich ist. Ammoniumiodid bildet kubische Kristalle, ist leicht zersetzbar und verfärbt infolge Oxidation des Iodid-Ions zu Iod I2 an der Luft gelb bis braun.[3][5] Die Verbindung kommt in drei Kristallstrukturen vor, wobei die Niedertemperaturform eine tetragonale Kristallstruktur mit der Raumgruppe P4/nmm (Raumgruppen-Nr. 129) besitzt.[6]
Synthese
Die Herstellung von Ammoniumiodid kann durch die Reaktion von Iod oder Iodwasserstoff mit Ammoniak oder Ammoniumcarbonat erfolgen:
Bei der Reaktion zwischen Iod I2 mit Ammoniakwasser ist jedoch Vorsicht geboten, da sehr leicht Iodstickstoff gebildet wird.
Im Labor erhält man Ammoniumiodidlösung ähnlich aus 10 % Ammoniakwasser, Iod und Wasserstoffperoxid:[7]
Verwendung
Verwendung findet Ammoniumiodid in der phototechnischen Industrie[3] und in der Medizin.
Einzelnachweise
- ↑ Eintrag zu AMMONIUM IODIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 13. November 2021.
- ↑ a b c d Eintrag zu Ammoniumiodid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- ↑ a b c d The Merck Index - Fifteenth Edition. Royal Society of Chemistry, 2013, ISBN 978-1-84973-670-1, S. 92 (englisch).
- ↑ a b Datenblatt Ammonium iodide, 98+% bei Alfa Aesar, abgerufen am 1. Februar 2019 (Seite nicht mehr abrufbar).
- ↑ Ammoniumjodid – Artikel in Meyers Konversationslexikon, Verlag des Bibliographischen Instituts, Leipzig und Wien, Vierte Auflage, 1885–1892
- ↑ High Pressure Phase Transformations: A Handbook. CRC Press, 1992, ISBN 978-2-88124-759-0, S. 445 (books.google.de).
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 289–90.
