Ammoniumdithionat
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
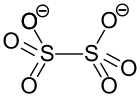 | |||||||
| Allgemeines | |||||||
| Name | Ammoniumdithionat | ||||||
| Summenformel | H8N2S2O6 | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 196,21 g·mol−1 | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Ammoniumdithionat ist eine anorganische Verbindung aus der Gruppe der Dithionate.
Herstellung
Ammoniumdithionat kann durch Reaktion von Mangandithionat mit Ammoniumcarbonat gewonnen werden.[2]
Eigenschaften
Ammoniumdithionat zerfällt bei etwa 242 °C. Das Dithionat-Ion bildet dabei unter Abgabe von Schwefeldioxid Sulfat.[3] Unter Bestrahlung bildet Ammoniumdithionat stabile SO3-Radikalanionen, die in Elektronenspinresonanz (EPR)-Messungen ein einzelnes klares Signal erzeugen. Dadurch eignet sich die Verbindung möglicherweise als Material für die EPR-Dosimetrie.[2]
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b M. Danilczuk, H. Gustafsson, M.D. Sastry, E. Lund, A. Lund: Ammonium dithionate—A new material for highly sensitive EPR dosimetry. In: Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. Band 69, Nr. 1, Januar 2008, S. 18–21, doi:10.1016/j.saa.2007.03.001.
- ↑ G. Tammann, W. Boehme: Zur Zersetzung der Dithionate. In: Zeitschrift für anorganische und allgemeine Chemie. Band 204, Nr. 1–2, 9. Februar 1932, S. 143–144, doi:10.1002/zaac.19322040114.