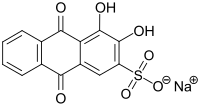
Alizarinrot S
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Alizarinrot S | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C14H7NaO7S | ||||||||||||||||||
| Kurzbeschreibung |
dunkelrotes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 342,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Alizarinrot S (auch C.I. Mordant Red 3, Alizarin Karmin, C.I 58005) ist ein Farbstoff und pH-Indikator aus der Gruppe der Alizarine.
Eigenschaften
Alizarinrot S wurde 1871 von Carl Gräbe and Carl Theodor Liebermann entwickelt.[3] Es ist ein pH-Indikator für pH 4,3–6,3 und pH 9,4–12,0.[2] Alizarinrot S wird in der Histologie und Pathologie zur histologischen Färbung von Calciumverbindungen verwendet[4][5][6] und färbt Calcium ziegelrot.[7] Die Färbung von Calcium erfolgt am besten bei pH 9.[8] Die Färbung mit Alizarinrot S ist die Standardmethode bei der mikroskopischen Quantifizierung der Mineralisierung von Osteoblasten.[9] In Verbindung mit Alcianblau wird es zur Färbung von Skeletten von Mäusen verwendet.[10]
In der Augenheilkunde wird Alizarinrot S zur Untersuchung von Verkalkungen in der Augenlinse eingesetzt.[11] In Korallen wird Alizarinrot S zur Färbung von täglichen Wachstumsschichten verwendet.[12] Ebenso wird es in der Geologie zur Färbung von Carbonaten eingesetzt.[13] Obwohl unter den Anthrachinon-Derivaten einige genotoxisch sind und in doppelsträngige DNA interkalieren, ist Alizarinrot S weder zyto- noch genotoxisch.[14]
-
 Alizarinrot S als Pulver
Alizarinrot S als Pulver -
 Skelettfärbung bei einer Ratte, mit Calcium-reichen Bereichen in dunkelrot
Skelettfärbung bei einer Ratte, mit Calcium-reichen Bereichen in dunkelrot -
 Skelettfärbung bei Nematistius pectoralis
Skelettfärbung bei Nematistius pectoralis -
Einzelnachweise
- ↑ a b Eintrag zu Alizarinrot S Natriumsalz in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Februar 2025. (JavaScript erforderlich)
- ↑ a b c Carl Roth Deutschland: Alizarinrot S (C.I. 58005), 10 g, CAS No. 130-22-3, abgerufen am 7. Februar 2025.
- ↑ Lea Legan, Klara Retko, Polonca Ropret: Vibrational spectroscopic study on degradation of alizarin carmine. In: Microchemical Journal. 127. Jahrgang, 2016, S. 36–45, doi:10.1016/j.microc.2016.02.002 (englisch).
- ↑ Holde Puchtler, Susan N. Meloan, Mary S. Terry: On the history and mechanism of alizarin and alizarin red S stains for calcium. In: Journal of Histochemistry & Cytochemistry. 17. Jahrgang, Nr. 2, 1969, S. 110–124, doi:10.1177/17.2.110, PMID 4179464 (englisch).
- ↑ John Bancroft, Alan Stevens (Hrsg.): The Theory and Practice of Histological Techniques. 2nd Auflage. Longman Group Limited, 1982 (englisch).
- ↑ Ralph Dougall Lillie: H. J. Conn's Biological stains. 9th Auflage. Williams & Wilkins, Baltimore 1977, S. 692p (englisch).
- ↑ M. Lievremont, J. Potus, B. Guillou: Use of alizarin red S for histochemical staining of Ca2+ in the mouse; some parameters of the chemical reaction in vitro. In: Acta anatomica. Band 114, Nummer 3, 1982, S. 268–280, doi:10.1159/000145596, PMID 7158284.
- ↑ H. Puchtler, S. N. Meloan, M. S. Terry: On the history and mechanism of alizarin and alizarin red S stains for calcium. In: The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. Band 17, Nummer 2, Februar 1969, S. 110–124, doi:10.1177/17.2.110, PMID 4179464.
- ↑ A. Bernar, J. V. Gebetsberger, M. Bauer, W. Streif, M. Schirmer: Optimization of the Alizarin Red S Assay by Enhancing Mineralization of Osteoblasts. In: International Journal of Molecular Sciences. Band 24, Nummer 1, Dezember 2022, S. , doi:10.3390/ijms24010723, PMID 36614166, PMC 9821450 (freier Volltext).
- ↑ T. J. Mead: Alizarin Red and Alcian Blue Preparations to Visualize the Skeleton. In: Methods in molecular biology. Band 2043, 2020, S. 207–212, doi:10.1007/978-1-4939-9698-8_17, PMID 31463914.
- ↑ P. Kanclerz, T. M. Yildirim, R. Khoramnia: Microscopic Characteristics of Late Intraocular Lens Opacifications. In: Archives of pathology & laboratory medicine. Band 145, Nummer 6, Juni 2021, S. 759–767, doi:10.5858/arpa.2019-0626-RA, PMID 33091924.
- ↑ Michael Holcomb, Anne L. Cohen, Daniel C. McCorkle: An evaluation of staining techniques for marking daily growth in scleractinian corals. In: Journal of Experimental Marine Biology and Ecology. 440. Jahrgang, 2013, S. 126–131, doi:10.1016/j.jembe.2012.12.003 (englisch, mblwhoilibrary.org [PDF]).
- ↑ J. A. D. Dickson: Carbonate identification and genesis as revealed by staining. In: Journal of Sedimentary Research. 36. Jahrgang, Nr. 4, 1966, S. 491–505, doi:10.1306/74D714F6-2B21-11D7-8648000102C1865D (englisch).
- ↑ B. Bauer, H. Rossi, H. Hintzsche: Genotoxicity testing of the anthraquinone dye Alizarin Red S. In: Current research in toxicology. Band 8, 2025, S. 100208, doi:10.1016/j.crtox.2024.100208, PMID 39811826, PMC 1173128 (freier Volltext).