Abatacept
| Abatacept (INN[1]) | ||
|---|---|---|
| Andere Namen |
| |
| Masse/Länge Primärstruktur | 78,9 kDa | |
| Bezeichner | ||
| Externe IDs |
| |
| Arzneistoffangaben | ||
| ATC-Code | L04AA24 | |
| DrugBank | DB01281 | |
| Wirkstoffklasse | Immunsuppressiva | |
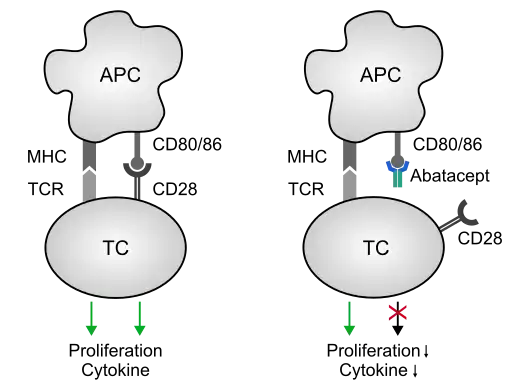
Abatacept ist ein biotechnologisch hergestelltes Protein, das medizinisch eingesetzt wird. Es imitiert die T-Zell-Downregulation einer Entzündungsreaktion. Es handelt sich um ein Fusionsprotein (CTLA4Ig), bei dem die extrazellulären Domäne des humanen zytotoxischen T-Lymphozyten-Antigens-4 (CTLA-4) an ein modifiziertes Fc-Fragment des humanen Immunglobulins G1 (IgG1) gebunden ist.[2] Abatacept ist seit Mai 2007 in der EU als Medikament zur Therapie der rheumatoiden Arthritis zugelassen (Präparatename Orencia, Bristol-Myers Squibb).[3] Es wird mit Methotrexat kombiniert.
Wirkungsmechanismus
T-Zellen aktivieren über CD28 auf ihrer Oberfläche die Rezeptoren CD80 und CD86 auf B-Zellen und aktivieren diese. Soll diese Entzündungsreaktion beendet werden, exprimieren T-Zellen CTLA-4 (CD156), welches mit einer höheren Affinität an CD80 und CD86 der B-Zellen bindet und eine Downregulation der Entzündungsreaktion zur Folge hat.[2]
Insbesondere T-Helferzellen und regulatorische T-Helferzellen tragen auf ihrer Zelloberfläche CTLA-4 und verhindern so überschießende Immunreaktionen.
Einzelnachweise
- ↑ INN Recommended List 53, 9. März 2005.
- ↑ a b M. Dall’Era, J. Davis: CTLA4Ig: a novel inhibitor of costimulation. In: Lupus. Band 13, Nr. 5, Mai 2004, ISSN 0961-2033, S. 372–376, doi:10.1191/0961203303lu1029oa (sagepub.com [abgerufen am 3. Mai 2025]).
- ↑ Eintrag EU/1/07/389 im Unionsregister für Humanarzneimittel. In: ec.europa.eu. 7. Februar 2025, abgerufen am 3. Mai 2025 (englisch).
- ↑ Orencia - Scientific Discussion (Assessment Report), EMA, Juni 2005.