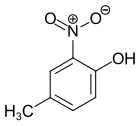
4-Methyl-2-nitrophenol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 4-Methyl-2-nitrophenol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C7H7NO3 | |||||||||||||||||||||
| Kurzbeschreibung |
gelber Feststoff mit phenolartigem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 153,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Dichte |
1,24 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt |
32 °C[1] | |||||||||||||||||||||
| Siedepunkt |
230 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
4-Methyl-2-nitrophenol ist eine chemische Verbindung aus der Gruppe der Nitrophenole und Kresole.
Herstellung
Die Darstellung von 4-Methyl-2-nitrophenol durch Nitrierung von p-Kresol mit verdünnter Salpetersäure in Benzol wurde 1907 von Gustav Schultz beschrieben.[3][4]
.svg.png)
Alternativ wird p-Toluidin durch salpetrige Säure diazotiert und nitrosiert. Das erhaltene Produkt wird in situ durch Zugabe von wässriger Salpetersäure zur Nitroverbindung oxidiert und durch die anschließende Hydrolyse (Phenolverkochung) erhält man 4-Methyl-2-nitrophenol.[2]
.svg.png)
Eigenschaften
Die Umsetzung von konzentrierter oder rauchender Schwefelsäure auf 4-Methyl-2-nitrophenol entsteht kein Sulfonierungsprodukt, sondern unter Spaltung des Benzolrings das 3-Methylmuconolacton.[5]

Verwendung
Eine alkalische wässrige Lösung von 4-Methyl-2-nitrophenol kann mit Methylchlorid unter Druck zu 1-Methoxy-4-methyl-2-nitrobenzol umgesetzt werden.
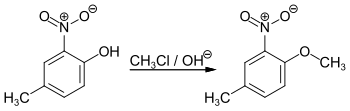
Durch anschließende Reduktion mit Eisen und Ameisensäure erhält man p-Kresidin, ein Ausgangsprodukt für Azofarbstoffe.[2]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu 2-Nitro-p-kresol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Februar 2023. (JavaScript erforderlich)
- ↑ a b c Gerald Booth: Ullmann’s Encyclopedia of Industrial Chemistry. Band 24. Wiley-VCH Verlag & Co. KGaA, Weinheim 2000, ISBN 978-3-527-30673-2, Nitro Compounds, Aromatic, S. 342, doi:10.1002/14356007.a17_411.
- ↑ G. Schultz: Über Amido‐phenol‐sulfosäuren und Amido‐kresol‐sulfosäuren. In: Berichte der deutschen chemischen Gesellschaft. Band 40, Nr. 4, 1907, S. 4324–4325, doi:10.1002/cber.19070400457.
- ↑ Josef Houben (Hrsg.): Houben-Weyl Methods of Organic Chemistry. Nitrogen Compounds. 3. Auflage. Band IV. Georg Thieme Verlag, Leipzig 1941, S. 210 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. Pauly, R. Gilmour, G. Will: Eine direkte Benzolringspaltung ohne Abbau. I. In: Justus Liebigs Annalen der Chemie. Band 403, Nr. 2–3, 1914, S. 119–167, doi:10.1002/jlac.19144030202.
