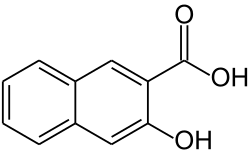
3-Hydroxy-2-naphthoesäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Hydroxy-2-naphthoesäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C11H8O3 | ||||||||||||||||||
| Kurzbeschreibung |
gelber Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 188,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,43 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
3-Hydroxy-2-naphthoesäure ist eine chemische Verbindung aus der Gruppe der aromatischen Carbonsäuren und Naphthole.
Geschichte
Die Synthese von 3-Hydroxy-2-naphthoesäure wurde erstmals 1887 von Rudolf Schmitt und E. Burkard beschrieben[3] und ihre Eignung als Kupplungskomponente wurde 1893 durch Stanislaus von Kostanecki gezeigt.[4] 1903 wurde bei der Agfa durch Richard Gley und Otto Siebert Pigment Red 57:1 entdeckt und patentiert,[5][6] ein wichtiger Vertreter der verlackten BONS-Pigmente, die aus 3-Hydroxy-2-naphthoesäure als Kupplungskomponente hergestellt werden. Die Abkürzung BONS ergibt sich aus dem früher gebräuchlichen Namen Beta-Oxynaphtoesäure der Verbindung. 1911 wurde im Werk Offenbach der Chemischen Fabrik Griesheim-Elektron durch L. A. Laska, Arthur Zitscher und Adolf Winther die Anilide der 3-Hydroxy-2-naphthoesäure, die unter der Bezeichnung Naphthol AS vermarktet wurden, als Kupplungskomponenten für Entwicklungsfarbstoffe entwickelt und patentiert.[7][8]
Gewinnung und Darstellung
3-Hydroxy-2-naphthoesäure kann in einer Kolbe-Schmitt-Reaktion durch Umsetzung von Kohlendioxid mit dem Natriumsalz von β-Naphthol unter Druck gewonnen werden.[8]
Eigenschaften
3-Hydroxy-2-naphthoesäure ist ein brennbarer, schwer entzündbarer kristalliner gelber Feststoff, der praktisch unlöslich in Wasser ist.[1]
Verwendung
3-Hydroxy-2-naphthoesäure wird als Zwischenprodukt zur Herstellung von Farbstoffen und Pigmenten, das auch für pharmazeutische Anwendungen eingesetzt werden kann, verwendet.[9]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu 3-Hydroxy-2-naphthoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5, S. 324 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ R. Schmitt, E. Burkard: Ueber Naphtolcarbonsäuren. In: Berichte der deutschen chemischen Gesellschaft. Band 20, Nr. 2, 1887, S. 2699–2702, doi:10.1002/cber.188702002118.
- ↑ St. V. Kostanecki: Notiz über die 2, 3-Oxynaphtoësäure. In: Berichte der deutschen chemischen Gesellschaft. Band 26, Nr. 3, 1893, S. 2897–2900, doi:10.1002/cber.189302603107.
- ↑ Patent US743071A: Monoazo Dye And Process Of Makeing Same. Angemeldet am 26. März 1903, veröffentlicht am 3. November 1903, Anmelder: Actien Gesellschaft für Anilin Fabrikation, Erfinder: Richard Gley, Otto Siebert.
- ↑ Patent US741029A: Red Azo Lake. Angemeldet am 26. März 1903, veröffentlicht am 13. Oktober 1903, Anmelder: Actien Gesellschaft für Anilin Fabrikation, Erfinder: Richard Gley, Otto Siebert.
- ↑ Patent DE261594: Verfahren zur Darstellung von Monoazofarbstoffen. Angemeldet am 18. Mai 1912, veröffentlicht am 27. Juni 1913, Anmelder: Chemische Fabrik Griesheim-Elektron.
- ↑ a b Klaus Hunger, Peter Mischke, Wolfgang Rieper, Shufen Zhang: Ullmann's Encyclopedia of Industrial Chemistry. John Wiley & Sons, Ltd, 2019, ISBN 978-3-527-30673-2, Azo Dyes, 5. Developing Dyes, S. 1–19, doi:10.1002/14356007.o03_o09.pub2.
- ↑ OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für 2-Hydroxy-3-napthoic acid, abgerufen am 6. März 2019.

