3-Chlor-1-propanol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
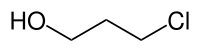
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Chlor-1-propanol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H7ClO | ||||||||||||||||||
| Kurzbeschreibung |
klare farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 94,019 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,131 g·cm−3[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
3-Chlor-1-propanol ist eine chemische Verbindung vom Typ eines linearen C3-Chlorhydrins.
Gewinnung und Darstellung
3-Chlor-1-propanol wurde erstmals 1916 von C. G. Derick und D. W. Bissell durch Reaktion von 1,3-Propandiol mit Chlorwasserstoff bei 100 °C synthetisiert. Diese Methode liefert allerdings nur eine sehr geringe Ausbeute.[2] Technisch wird 3-Chlor-1-propanol schon seit den 1930er Jahren unter Katalyse aus Ethen, Formaldehyd und Chlorwasserstoff synthetisiert.[3] Das Patent wurde von der IG Farben angemeldet.
Verwendung
3-Chlor-1-propanol wird in der medizinischen Chemie als Linker eingesetzt.[4] Abgesehen davon kann es zu Oxetan kondensiert werden.
Sicherheitshinweise
3-Chlor-1-propanol hat einen Flammpunkt von 75 °C.[1]
Einzelnachweise
- ↑ a b c d e f g h Datenblatt 3-Chlor-1-propanol bei Sigma-Aldrich, abgerufen am 15. Dezember 2022 (PDF).
- ↑ C. G. Derick, D. W. Bissell: STUDIES OF TRIMETHYLENE OXIDE. I. PREPARATION AND CHARACTERIZATION. In: Journal of the American Chemical Society. Band 38, Nr. 11, 1916, S. 2478–2486, doi:10.1021/ja02268a023.
- ↑ Patent DE673681: Verfahren zur Darstellung von halogensubstituierten Alkoholen. Veröffentlicht am 27. März 1939, Erfinder: Wilhelm Fitzky.
- ↑ H. Prescher, S. A. Gütgemann, C. Watzl, R. Brossmer: Design, synthesis, and biological evaluation of small, high-affinity siglec-7 ligands. In: Journal of Medicinal Chemistry. Band 60, Nr. 03, 2017, S. 941–956, doi:10.1021/acs.jmedchem.6b01111.
