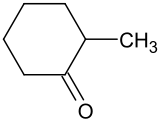
2-Methylcyclohexanon
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Methylcyclohexanon | ||||||||||||||||||
| Summenformel | C7H12O | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit acetonähnlichem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 112,17 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,93 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
165 °C[2] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | ||||||||||||||||||
| Brechungsindex |
1,45 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten |
1980 mg·kg−1 (LD50, Ratte, oral)[1] | ||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2-Methylcyclohexanon ist eine organische Verbindung aus der Gruppe der cyclischen Ketone.
Herstellung
2-Methylcyclohexanon kann hergestellt werden, indem Cyclohexanon zunächst mit Pyrrolidin zu einem Enamin umgesetzt wird und dieses erst mit Methyliodid methyliert und dann hydrolysiert wird.[3]
Reaktionen
Die Reduktion von 2-Methylcyclohexanon ergibt 2-Methylcyclohexanol. Mit Natrium / Ethanol, Lithiumaluminiumhydrid oder Natriumborhydrid entsteht bevorzugt das trans-Isomer. Aluminiumisopropanolat ergibt eher das cis-Isomer, katalytische Hydrierung hauptsächlich das cis-Isomer.[4] Wird 2-Methylcyclohexanon zum Enolat deprotoniert und dann mit Methyliodid umgesetzt, entsteht bevorzugt 2,2-Dimethylcyclohexanon.[5] Bei der elektrochemischen Oxidation von 2-Methylcyclohexanon in Dichlormethan in Gegenwart von Trifluoressigsäure entsteht bevorzugt Heptano-1,5-lacton.[6]
Einzelnachweise
- ↑ a b c d Eintrag zu 2-Methylcyclohexanon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Mai 2025. (JavaScript erforderlich)
- ↑ a b c d e f g Eintrag zu 2-Methylcyclohexanone, >96.0% bei TCI Europe, abgerufen am 12. Mai 2025.
- ↑ Sunil Kumar Talapatra, Bani Talapatra: Cyclohexanone. In: Basic Concepts in Organic Stereochemistry. Springer International Publishing, Cham 2022, ISBN 978-3-03095989-0, S. 169, doi:10.1007/978-3-030-95990-6_8.
- ↑ V. K. Ahluwalia: Reduction of Specific Types of Organic Compounds. In: Reduction in Organic Synthesis. Springer Nature Switzerland, Cham 2023, ISBN 978-3-03137685-6, S. 85–86, doi:10.1007/978-3-031-37686-3_3.
- ↑ Sunil Kumar Talapatra, Bani Talapatra: Cyclohexanone. In: Basic Concepts in Organic Stereochemistry. Springer International Publishing, Cham 2022, ISBN 978-3-03095989-0, S. 91, doi:10.1007/978-3-030-95990-6_8.
- ↑ K. Fujimoto, N. Yamashita, Y. Tokuda, Y. Matsubara, H. Maekawa, T. Mizuno, I. Nishiguchi: Unusual rearrangement by anodic oxidation of cycloalkanones in the presence of trifluoroacetic acid. In: Electrochimica Acta. Band 42, Nr. 13-14, Januar 1997, S. 2265–2266, doi:10.1016/S0013-4686(97)85508-9.

