2-Methyl-1,5-diaminopentan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie – 1:1-Gemisch der Enantiomeren | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Methyl-1,5-diaminopentan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H16N2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 116,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser[1] | ||||||||||||||||||
| Brechungsindex |
1,4588 (25 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2-Methyl-1,5-diaminopentan, MPMD, ist ein verzweigtes aliphatisches primäres Diamin, das u. a. als Building Block für Vitamine, als Ausgangsstoff für Diisocyanate, als Härter für Epoxidharze und als Diaminkomponente für Polyamide Verwendung findet.[2]
Vorkommen und Darstellung
Die österreichischen Chemiker Adolf Franke und Moritz Kohn publizierten bereits 1902 eine Synthese für 2-Methyl-1,5-diaminopentan aus 1,3-Dibrombutan[5] durch Kolbe-Nitrilsynthese mit Kaliumcyanid zu 2-Methylglutaronitril

und anschließende Hydrierung mit Natrium in siedendem Ethanol.[6]
Das bei der Dimerisierung von Acrylnitril durch Kopf-Schwanz-Verknüpfung entstehende 2-Methylenglutaronitril liefert bei vollständiger Hydrierung 2-Methylpentamethylendiamin in 80 %iger Ausbeute neben 3-Methylpiperidin (18 %).[7]

Die von Ni0-Phosphor-Komplexen katalysierte, als Hydrocyanierung bezeichnete, Addition von Cyanwasserstoff HCN an 1,3-Butadien liefert ein Gemisch von stellungsisomeren Pentennitrilen[8][9] mit der Hauptkomponente 3-Pentennitril 3PN (Vorstufe für Adiponitril) und der wichtigsten Nebenkomponente 2-Methyl-3-butennitril 2M3BN.
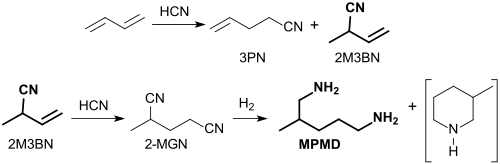
Weitere Hydrocyanierung von 2M3BN führt zum 2-Methylglutaronitril 2-MGN, das zur Zielverbindung 2-Methylpentan-1,5-diamin (neben wenig 3-Methylpicolin) hydriert wird.[10]
Die Synthese von 2-Methyl-1,5-diaminopentan aus einem Abfallprodukt des in industriellem Maßstab (ca. 2 Millionen Tonnen globale Kapazität[11]) hergestellten Adipodinitril (Ausgangsstoff für die Nylon 6.6-Diamin-komponente Hexamethylendiamin HMDA, sowie in geringerem Ausmaß auch für die Dicarbonsäure-komponente Adipinsäure) scheint die ökonomischste Variante zu sein.
Eigenschaften
2-Methyl-1,5-diaminopentan ist eine farblose, klare Flüssigkeit mit aminartigem Geruch, dessen wässrige Lösungen alkalisch reagieren (pH 12,1 in 5 %iger Lösung bei 25 °C[2]).
Anwendungen
MPMD als Funktionschemikalie
Korrosionsinhibitor: wie andere Diamine, z. B. Isophorondiamin, ist 2-Methyl-1,5-pentamethylendiamin ein wirksames Korrosionsschutzmittel in wässrigen Medien in Kontakt mit Eisenoberflächen.
Kühlschmiermittel: in Bohr-Schneidemulsionen unterdrückt 2-Methylpentan-1,5-diamin Oxidation und Verfärbung der bearbeiteten Metalloberflächen und verlängert die Funktionsdauer von Fräs-, Bohr- und Schneidwerkzeugen.
MPMD als Building Block
Als verzweigtes aliphatisches Diamin eignet sich 1,5-Diamino-2-methylpentan zur Darstellung von Diisocyanaten durch Umsetzung mit Phosgen. Im Vergleich zu Hexamethylendiisocyanat HDI reduziert MPMD-Diisocyanat die Schmelztemperatur und erhöht die Flexibilität von Heißklebern.
Wegen seiner breiten Verfügbarkeit ist 1,5-Diamino-2-methylpentan ein bevorzugter Ausgangsstoff für die B-Vitamine Nicotinsäure bzw. Nicotinamid (Niacinamid). Dazu wird das Diamin MPMD unter Abspaltung von Ammoniak bei 335 °C praktisch quantitativ (>99,5 % Ausbeute) zu 3-Methylpiperidin MPI an einem Zeolithkontakt cyclisiert, das anschließend an einem Palladium-Magnesiumchlorid-Aluminiumoxid-Kontakt bei 280 °C mit 99,3 % Ausbeute zu 3-Methylpyridin (β-Picolin) dehydriert wird.
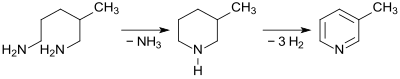
Die Reaktionsfolge kann auch ohne Isolierung des Zwischenprodukts MPI in zwei hintereinander geschalteten Reaktoren durchgeführt werden und liefert dann 3-Methylpyridin in 99,1 %iger Ausbeute.[12]
In der weiteren Niacinamidsynthese wird β-Picolin durch eine Ammonoxidation mit Luftsauerstoff und Ammoniak bei 330 °C in 95 %iger Ausbeute in 3-Cyanpyridin überführt, das biotechnologisch mittels immobilisierter Rhodococcus-Bakterien der Art Rhodococcus rhodochrous praktisch quantitativ zu Nicotinsäureamid umgesetzt wird.[13]
MPMD als Reaktivkomponente in Polymeren
Der Einbau des verzweigten Diamins 2-Methyl-1,5-pentandiamin in polymere Materialien stört die parallele Anordnung der Polymerketten und behindert bzw. verhindert die Ausbildung kristalliner Strukturen. MPMD-haltige Polymere haben daher niedrigere Glasübergangstemperaturen bzw. Schmelztemperaturen. Sie sind meist leichter verarbeitbar und besitzen in vielen Fällen verbesserte Materialeigenschaften.
Epoxide: 2-Methyl-1,5-diaminopentan ist bereits bei niedrigen Temperaturen ein schneller und effizienter Härter und verkürzt die Gelierzeit bei Erhaltung der mechanischen Festigkeit von Epoxidharzen.
Polyurethane und Polyharnstoffe: 2-Methyl-1,5-pentamethylendiamin kann als Kettenverlängerer (engl. chain extender) und Vernetzer (engl. cross-linker) in Polyurethanen eingesetzt werden. Mit Diisocyanaten reagiert MPMD zu Polyharnstoffen.
Polyamide: in aliphatischen Polyamiden bewirkt der Einbau des asymmetrischen Diamins 2-Methyl-1,5-diaminopentan eine deutliche Absenkung der Schmelztemperatur (Nylon 6,6: TM=265 °C; Nylon MPMD,6: TM=184 °C), und Quenchen (rasches Abkühlen) der Schmelze lässt das MPMD-haltige Polyamid amorph erstarren. Dadurch eignen sich solche Polyamide als Heißkleber, für Pulverbeschichtungen und 3D-Druck. In teilaromatischen Polyamiden (Polyphthalamide mit Terephthalsäure PTA oder Isophthalsäure als Dicarbonsäurekomponenten) erniedrigt 2-Methyl-1,5-pentandiamin die Kristallinität, verbessert mechanische Eigenschaften, wie z. B. die Biegefestigkeit, und erhöht die Transparenz. Der Anteil teurer Reaktanden, z. B. Isophthalsäure, kann bei Zugabe von MPMD reduziert werden.[2]
Hersteller und Handelsnamen
2-Methylpentamethylendiamin wurde ursprünglich DuPont entwickelt und auf den Markt gebracht. Heute ist es ein Produkt der Invista, die zu dem US-amerikanischen Unternehmen Koch Industries gehört und MPMD unter dem Markennamen DYTEK® A vermarktet.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu 2-Methylpentan-1,5-diamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2025. (JavaScript erforderlich)
- ↑ a b c d e Technical Information, DYTEK® A Amine. (PDF) Invista, 5. März 2018, abgerufen am 22. April 2020.
- ↑ Eintrag zu 2-Methyl-1,5-diaminopentane bei TCI Europe, abgerufen am 22. April 2020.
- ↑ Datenblatt 1,5-Diamino-2-methylpentan bei Sigma-Aldrich, abgerufen am 22. April 2020 (PDF).
- ↑ A. Franke, M. Kohn: Über eine Synthese alkylierter Glutarsäuren aus β-Glycolen. In: Monatsh. Chem. Band 23, 1902, S. 740–746, doi:10.1007/BF01524932.
- ↑ A. Franke, M. Kohn: Über eine Synthese alkylierter Pentamethylendiamine und alkylierter Piperidine aus β-Glycolen. In: Monatsh. Chem. Band 23, 1902, S. 877–885, doi:10.1007/BF01536355.
- ↑ Patent US3408397: Methyl pentamethylene diamine process. Angemeldet am 1. Juni 1965, veröffentlicht am 31. Oktober 1967, Anmelder: National Destillers and Chemical Corp., Erfinder: J. Feldman, M. Thomas.
- ↑ Patent EP2041075B1: Process for making 3-pentenenitrile from butadiene. Angemeldet am 13. Juli 2007, veröffentlicht am 25. März 2015, Anmelder: Invista Technologies S.à.r.l., Erfinder: T. Foo, S.S. Kristjansdottir, R.J. McKinney, R. Ozer.
- ↑ N. Herrmann, D. Vogelsang, A. Behr, T. Seidensticker: Homogeneously catalyzed 1,3-diene functionalization: A success story from laboratory to miniplant scale. In: Chem. Cat. Chem. Band 10, Nr. 23, 2018, S. 5342–5365, doi:10.1002/cctc.201801362.
- ↑ Patent US4987263: Preparation of 2-methylpentadiamine. Angemeldet am 12. August 1988, veröffentlicht am 22. Januar 1991, Anmelder: Rhone-Poulenc Chimie, Erfinder: G. Cordier.
- ↑ Adiponitrile plant Shanghai Invista – Archive. Polyestertime, 25. Februar 2019, abgerufen am 24. April 2020.
- ↑ Patent EP0691955B1: Verfahren zur Herstellung von 3-Methylpiperidin und 3-Methylpyridin durch katalytische Cyclisierung von 2-Methyl-1,5-diaminopentan. Angemeldet am 30. März 1994, veröffentlicht am 28. Mai 1997, Anmelder: Lonza AG, Erfinder: J. Heveling, E. Armbruster, W. Siegrist.
- ↑ Patent US5719045: Process for preparing nicotinamide. Angemeldet am 31. Oktober 1996, veröffentlicht am 17. Februar 1998, Anmelder: Lonza AG, Erfinder: J. Heveling, E. Armbruster, L. Utiger, M. Rohner, H.-R. Dettwiler, R.J. Chuck.

