2,3-Dimethylbuttersäuremethylester
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
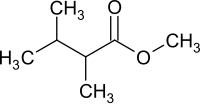
| ||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | ||||||||||
| Allgemeines | ||||||||||
| Name | 2,3-Dimethylbuttersäuremethylester | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C7H14O2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 130,187 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig[1] | |||||||||
| Siedepunkt |
124–126 °C[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
2,3-Dimethylbuttersäuremethylester ist eine chemische Verbindung aus der Gruppe der chiralen aliphatischen Carbonsäureester. Es handelt sich um den Methylester der 2,3-Dimethylbuttersäure.
Vorkommen
Die Verbindung findet sich als flüchtige Komponente im Gießkannenschimmel Emericella nidulans[3] und in Holzfäule.[4]
Darstellung
Aus 2,3-Dimethylbuttersäure kann der Methylester entweder mit Thionylchlorid und Methanol über das entsprechende Säurechlorid dargestellt werden[1] oder direkt mit Diazomethan.[5] Ein alternativer Zugang ist die Hydrocarboxylierung von 2-Methyl-2-buten mit Methanol und Kohlenstoffmonoxid unter Zuhilfenahme eines Palladium-Katalysators. Hierbei wird ein Isomerengemisch der Titelverbindung mit einer größeren Menge 4-Methylpentansäuremethylester sowie Spuren von 3-Methylpentansäuremethylester erhalten, das dann noch aufgetrennt werden muss.[6] Beim Versuch enantioselektiver Synthese mit (−)-DIOP als chiralem Liganden im katalytischen Komplex wurde dabei nur ein sehr geringer Enantiomerenüberschuss beobachtet.[7]
Reaktionen
Die Einführung eines weiteren α-ständigen Substituenten gelingt nach Deprotonierung der schwach CH-aciden Position mit Lithiumdiisopropylamid durch Umsetzung mit dem entsprechenden Alkylhalogenid, vorteilhafterweise mit vorheriger Fixierung der Endiolform mit Trimethylsilylchlorid als Trimethylsilylenolether. Auf diesem Wege können stark verzweigte Koch-Säureester wie 2-Isopropyl-2,3-dimethylbuttersäuremethylester dargestellt werden.[8] Bei Umsetzung des Carbanions mit Bromacetonitril entsteht zu etwa gleichen Teilen 2-Brom-2,3-dimethylbuttersäuremethylester und ein Cyanoester. Aus letzterem kann mit Natriumborhydrid in Gegenwart katalytischer Mengen Cobalt(II)-chlorid-Hexahydrat das γ-Lactam 3-Isopropyl-3-methyl-2-pyrrolidinon erhalten werden.[9]
Mit Grignad-Reagenzien können aus 2,3-Dimethylbuttersäuremethylester 1,1-substituierte 2,3-Dimethylbut-1-ene wie das unsymmetrische Diphenylalken 1,1-Bis-(p-methoxyphenyl)-2,3-dimethylbut-1-en dargestellt werden.[10]
Einzelnachweise
- ↑ a b c R. Ikan, A. Markus, E. D. Bergmann: Synthesis of campesteryl acetate ((24R)-24-methyl-3β-acetoxycholesten-5-ene) and its 24S-epimer. In: Steroids, 1970, Band 16, S. 517–522, doi:10.1016/S0039-128X(70)80133-7.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Guido Fischer, Regina Schwalbe, Manfred Möller, Rene Ostrowski, Wolfgang Dott: Species-specific production of microbial volatile organic compounds (MVOC) by airborne fungi from a compost facility. In: Chemosphere, 1999, Band 39, S. 795–810, doi:10.1016/S0045-6535(99)00015-6.
- ↑ Rumi Konuma, Kiwamu Umezawa, Atsushi Mizukoshi, Kensuke Kawarada, Makoto Yoshida: Analysis of microbial volatile organic compounds produced by wood-decay fungi. In: Biotechnology Letters, 2015, Band 37, S. 1845–1852, doi:10.1007/s10529-015-1870-9.
- ↑ Tohru Kikuchi, Shigetoshi Kadota, Satoko Matsuda, Hisashi Suehara: Studies on the Constituents of Orchidaceous Plants. V. : Isolation, Structure, and C-13 Signal Assignments of Novel Methylsterols from Nervilia purpurea SCHLECHTER. In: Chemical and Pharmaceutical Bulletin, 1986, Band 34, S. 3183–3201, doi:10.1248/cpb.34.3183.
- ↑ Tyler Bredenkamp, Cedric Holzapfel: Toward the development of efficient and stable Pd-catalysts for the methoxycarbonylation of medium chain alkenes. In: Journal of the Iranian Chemical Society, 2016, Band 13, S. 421–427, doi:10.1007/s13738-015-0750-5.
- ↑ Giambattista Consiglio: Asymmetric Alkenes Hydroesterification by Palladium Complexes Containing (—)-DIOP. Double bond migration and formation of isomeric esters. In: Helvetica Chimica Acta, 1976, Band 59, S. 124–126, doi:10.1002/hlca.19760590112.
- ↑ Claude Lion, Jacques-Emile Dubois: Alkylation de quelques composés carbonylés par des groupes tertiaires. Utilisation de la réaction de friedel-crafts dans la synthèse d'ésters. In: Tetrahedron, 1981, Band 37, S. 319–323, doi:10.1016/S0040-4020(01)92017-4.
- ↑ P. Amruta Reddy, Bonnie C. H. Hsiang, Tammy N. Latifi, Matthew W. Hill, Karen E. Woodward, Steven M. Rothman, James A. Ferrendelli, Douglas F. Covey: 3,3-Dialkyl- and 3-Alkyl-3-Benzyl-Substituted 2-Pyrrolidinones: A New Class of Anticonvulsant Agents. In: Journal of Medicinal Chemistry, 1996, Band 39, S. 1898–1906, doi:10.1021/jm9600196.
- ↑ Jean-François Miquel, Hans Wåhlstam, Knut Olsson, Bertil Sundbeck: Synthesis of Unsymmetrical Diphenylalkenes. In: Journal of Medicinal Chemistry, 1963, Band 6, S. 774–780, doi:10.1021/jm00342a033.