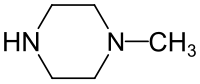
N-Methylpiperazin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | N-Methylpiperazin | ||||||||||||||||||
| Andere Namen |
1-Methylpiperazin | ||||||||||||||||||
| Summenformel | C5H12N2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit aminartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 100,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,903 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt |
−5,57 °C[2] | ||||||||||||||||||
| Siedepunkt |
138 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
N-Methylpiperazin ist eine organische Verbindung und ein Derivat des Piperazins mit einer zusätzlichen Methylgruppe.
Herstellung
N-Methylpiperazin kann ausgehend von Piperazin hergestellt werden. Dieses wird zunächst mit Benzoylchlorid zu N-Benzoylpiperazin umgesetzt. Als Nebenprodukt entsteht auch Dibenzoylpiperazin, das jedoch vergleichsweise leicht abgetrennt werden kann. Indem dieses Intermediat mit Formalin umgesetzt wird entsteht eine Methylenverbindung mit zwei Piperazineinheiten. Diese kann durch Reaktion mit Formaldehyd und Ameisensäure zu N-Benzoyl-N’-methylpiperazin umgesetzt werden, dessen Hydrolyse mit Salzsäure oder Natronlauge N-Methylpiperazin ergibt. Im Falle der sauren Hydrolyse wird das Dihydrochlorid erhalten.[3]
Reaktionen und Verwendung
Durch Reaktion von N-Methylpiperazin mit n-Butyllithium wird Lithium-N-methylpiperazid erhalten, das zur Einführung einer entsprechenden Schutzgruppe in aromatische Aldehyde dient.[4] Es ist ein Edukt in der Synthese diverser Pharmazeutika wie Clozapin,[5] Nintedanib,[6] Olanzapin[7] und Sildenafil.[8] Durch Reaktion von N-Methylpiperazin mit Carbonsäurechloriden wie Acetylchlorid, Propionylchlorid oder Isobutyrylchlorid werden entsprechende Amide erhalten.[9]
Einzelnachweise
- ↑ Eintrag zu N-Methylpiperazin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. März 2025. (JavaScript erforderlich)
- ↑ a b c d e f g h i Datenblatt 1-Methylpiperazin bei Sigma-Aldrich, abgerufen am 15. März 2025 (PDF).
- ↑ M. I. Dorokhova, E. N. Alekseeva, I. A. Kuznetsova, M. A. Portnov, Yu. M. Rozanova, O. Ya. Tikhnova, V. A. Mikhalev: Synthesis of 1-methylpiperazine. In: Pharmaceutical Chemistry Journal. Band 8, Nr. 12, Dezember 1974, S. 737–740, doi:10.1007/BF00779362.
- ↑ Daniel L. Comins, Sajan P. Joseph: Lithium N -Methylpiperazide. In: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2001, ISBN 978-0-471-93623-7, doi:10.1002/047084289x.rl128.
- ↑ Jie Jack Li, Douglas S. Johnson, Drago R. Sliskovic, Bruce D. Roth: Contemporary Drug Synthesis. John Wiley & Sons, 2004, ISBN 978-0-471-68673-6, S. 95 (google.de [abgerufen am 15. März 2025]).
- ↑ Daniel Lednicer: Antineoplastic Drugs: Organic Syntheses. John Wiley & Sons, 2015, ISBN 978-1-118-89255-8, S. 129 (google.de [abgerufen am 15. März 2025]).
- ↑ Daniel Lednicer: Antineoplastic Drugs: Organic Syntheses. John Wiley & Sons, 2015, ISBN 978-1-118-89255-8, S. 96–97 (google.de [abgerufen am 15. März 2025]).
- ↑ Jie Jack Li, Douglas S. Johnson, Drago R. Sliskovic, Bruce D. Roth: Contemporary Drug Synthesis. John Wiley & Sons, 2004, ISBN 978-0-471-68673-6, S. 194 (google.de [abgerufen am 15. März 2025]).
- ↑ I. Iriepa, A.I. Madrid, E. Gálvez, J. Bellanato: Synthesis, structural and conformational study of some amides derived from N-methylpiperazine. In: Journal of Molecular Structure. Band 787, Nr. 1–3, April 2006, S. 8–13, doi:10.1016/j.molstruc.2005.10.025.


