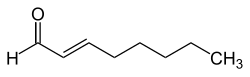
trans-2-Octenal
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | trans-2-Octenal | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C8H14O | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 126,20 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte |
0,846 g·cm−3 (25 °C)[2] | |||||||||||||||
| Siedepunkt |
84–86 °C (25 hPa)[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,45 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
trans-2-Octenal ist eine chemische Verbindung aus der Gruppe der Alkenale, also einem Aldehyd mit einer zusätzlichen C-C-Doppelbindung.
Vorkommen
trans-2-Octenal kommt natürlich als wichtiger Aromastoff unter anderem in Pilzen[4] und Lammfleisch[5], sowie in verschiedenen Früchten wie Melonen[3] vor.
Eigenschaften
trans-2-Octenal ist eine farblose Flüssigkeit mit grünem zitrusähnlichem Geruch.[2][6]
Verwendung
trans-2-Octenal wird zur Synthese anderer chemischer Verbindungen verwendet.[7]
Einzelnachweise
- ↑ Eintrag zu TRANS-2-OCTENAL in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. März 2022.
- ↑ a b c d e f g h Datenblatt trans-2-Octenal, ≥94% bei Sigma-Aldrich, abgerufen am 9. Mai 2012 (PDF).
- ↑ a b c trans-2-Octenal, 95 %, Thermo Scientific Chemicals – Fisher Scientific. In: fishersci.de. Abgerufen am 27. September 2024.
- ↑ Henry B. Heath: Source Book of Flavors. Springer, 1981, ISBN 978-0-87055-370-7, S. 269.
- ↑ Waldemar Ternes: Naturwissenschaftliche Grundlagen der Lebensmittelzubereitung. Behr’s, 2008, ISBN 978-3-89947-422-0, S. 468.
- ↑ David Rowe: Chemistry and Technology of Flavours and Fragrances. John Wiley & Sons, 2009, ISBN 978-1-4051-4807-8, S. 71 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Sentaro Okamoto, Kandasamy Subburaj, Fumie Sato: Highly Stereocontrolled Synthesis of Carbacyclin from Acyclic Starting Materials via Ti(II)-Mediated Tandem Cyclization. In: Journal of the American Chemical Society. Band 122, Nr. 45, 2000, S. 11244–11245, doi:10.1021/ja002974x.
