β-Ureidopropionase
| Β-Ureidopropionase | ||
|---|---|---|
| Andere Namen |
β-Alaninsynthase | |
| Masse/Länge Primärstruktur | 407,7 kDa | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.5.1.6, Hydrolase | |
| Reaktionsart | Hydrolyse | |
| Substrat | N-Carbamoyl-β-alanin Wasser | |
| Produkte | β-Alanin Kohlenstoffdioxid Ammoniak | |
| Orthologe (Mensch) | ||
| Entrez | 51733 | |
| Ensembl | ENSG00000100024 | |
| UniProt | Q9UBR1 | |
| Refseq (mRNA) | NM_016327 | |
| Genlocus | Chr 22: 24.49 – 24.53 Mb | |
| PubMed-Suche | 51733
| |
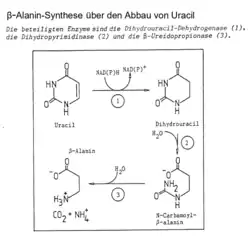
Die β-Ureidopropionase (EC 3.5.1.6) ist ein Enzym des reduktiven Uracil-Abbaus. Sie katalysiert die Hydrolyse von N-Carbamoyl-β-alanin. Bei dieser Reaktion wird die Aminosäure β-Alanin freigesetzt.[1][2][3] Das Reaktionsprodukt β-Alanin wird in Lebewesen zur Herstellung des Coenzyms A benötigt. Ein genetisch bedingter Mangel von β-Ureidopropionase führt beim Menschen zu der sehr seltenen Erbkrankheit β-Alanin-Synthase-Mangel, die zu Entwicklungsstörungen und neurologischen Symptomen führen kann.[4]
Die Struktur der β-Ureidopropionase aus Hefe wurde aufgeklärt. Sie zeigt eine hochgradige Homologie zu einer Familie der Exopeptidasen, so dass die Annahme nahe liegt, dass diese beiden Enzymgruppen einen gemeinsamen Ursprung haben.[5]
Einzelnachweise
- ↑ Robert L. Barnes, Aubrey W. Naylor: Formation of β-Alanine by Pine Tissues Supplied With Intermediates in Uracil & Orotic Acid Metabolism. In: Plant Physiology. Band 37, Nr. 2, 1. März 1962, ISSN 0032-0889, S. 171–175, doi:10.1104/pp.37.2.171, PMID 16655627, PMC 549758 (freier Volltext) – (oup.com [abgerufen am 28. Mai 2025]).
- ↑ Heinrich Zopes: Die Synthese und Funktion des Homglutathions in Chloroplasten von Phaseolus coccineus. Dissertation Universität zu Köln, Köln 1990.
- ↑ Thomas W. Traut, Steven Loechel: Pyrimidine catabolism: individual characterization of the three sequential enzymes with a new assay. In: Biochemistry. Band 23, Nr. 11, 22. Mai 1984, ISSN 0006-2960, S. 2533–2539, doi:10.1021/bi00306a033 (acs.org [abgerufen am 28. Mai 2025]).
- ↑ Orphanet: Beta-Ureidopropionase-Mangel. Abgerufen am 28. Mai 2025.
- ↑ Stina Lundgren, Zoran Gojković, Jure Piškur, Doreen Dobritzsch: Yeast β-Alanine Synthase Shares a Structural Scaffold and Origin with Dizinc-dependent Exopeptidases. In: Journal of Biological Chemistry. Band 278, Nr. 51, Dezember 2003, S. 51851–51862, doi:10.1074/jbc.M308674200 (elsevier.com [abgerufen am 2. Juni 2025]).